
科目: 来源: 题型:
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6 g。(提示:同一个C原子连两个羟基是不稳定结构)通过计算解决以下两个问题,要有必要计算过程:
(1)试推断该有机物的分子式。
(2)若0.2 mol该有机物恰好能与9.2 g金属钠完全反应,试确定该有机物的结构简式。
查看答案和解析>>
科目: 来源: 题型:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
______________________________________________________________________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
______________________________________________________________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是:
______________________________________________________________________。
(3)兰州一中某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
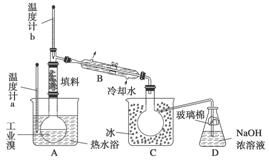
请你参与分析讨论:
①图中仪器B的名称是__________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?
_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
现有7瓶失去标签的液体,已知它们是有机试剂,可能是:①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄糖溶液、⑦蔗糖溶液。现通过如下实验步骤来确定各试剂瓶中所装的液体:
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 | 只有C仍有分层现象,且在D的试管中闻 到特殊香味 |
(1)试给它们的试剂瓶重新贴上标签,其中:
A____________, C____________, E________,F___________,G________。
(2)写出D与NaOH溶液的化学反应方程式:
_______________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,____________________;
④____________________,____________________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184gB和120gD反应能生成106gE,则该反应的产率______________________。
查看答案和解析>>
科目: 来源: 题型:
800℃时在2L密闭容器内反应:2NO(g)+O2(g) 2NO2(g)体系中,
2NO2(g)体系中,
n(NO)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡时NO的转化率_________________。
 (2)下图中表示NO2的变化的曲线是________, 用O2表示从0=2s内该反应的平均速率v(O2)=_____。
(2)下图中表示NO2的变化的曲线是________, 用O2表示从0=2s内该反应的平均速率v(O2)=_____。
(3)能说明该反应一定达到平衡状态的是_ _
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2V逆 (NO)=v正(O2) d.容器内压强保持不变
(4)能增大该反应的反应速率是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式
(4)化合物乙的电子式
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是
查看答案和解析>>
科目: 来源: 题型:
铜的冶炼大致可分为:①富集,将硫化物矿进行浮选;②焙烧,主要反应为
2CuFeS2+4O2===Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1 200 ℃发生的主要反应为
2Cu2S+3O2===2Cu2O+2SO2,2Cu2O+Cu2S===6Cu+SO2↑;④电解精炼铜。下列说法不正确
A.上述灼烧过程的尾气回收后可用来制硫酸
B.上述过程中,由6 mol CuFeS2制取6 mol Cu时共消耗15 mol O2
C.在反应2Cu2O+Cu2S===6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6
D.在反应2Cu2O+Cu2S===6Cu+SO2↑中,只有Cu2O作氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com