
科目: 来源:高考真题 题型:实验题
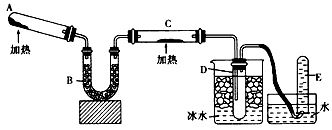
查看答案和解析>>
科目: 来源:同步题 题型:实验题
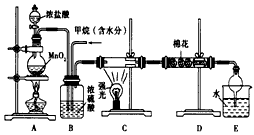
 ,若想理论上获得最多的氯化氢,则x≥__________
,若想理论上获得最多的氯化氢,则x≥__________查看答案和解析>>
科目: 来源:同步题 题型:实验题

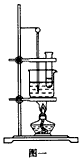
查看答案和解析>>
科目: 来源:同步题 题型:填空题
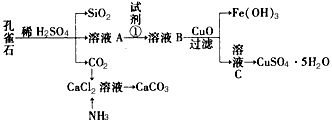
查看答案和解析>>
科目: 来源:同步题 题型:填空题
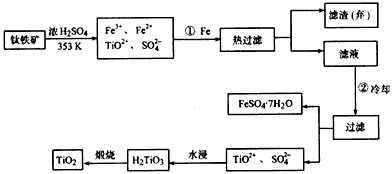
查看答案和解析>>
科目: 来源:同步题 题型:单选题
查看答案和解析>>
科目: 来源:专项题 题型:实验题
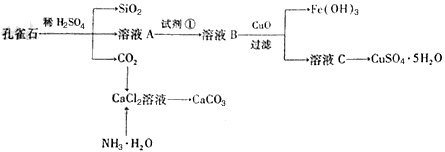
查看答案和解析>>
科目: 来源:同步题 题型:实验题
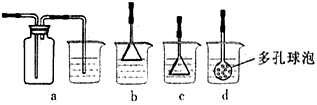
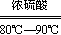 H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸。
H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸。 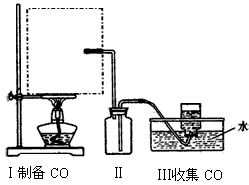


查看答案和解析>>
科目: 来源:专项题 题型:实验题
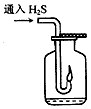

查看答案和解析>>
科目: 来源:专项题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com