
科目: 来源:0118 月考题 题型:实验题
查看答案和解析>>
科目: 来源:0110 期末题 题型:实验题
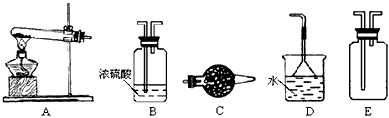
查看答案和解析>>
科目: 来源:江苏高考真题 题型:实验题
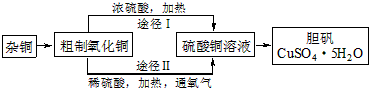
 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以 为原料制备少量高纯
为原料制备少量高纯 的操作步骤如下:
的操作步骤如下:  溶液:在烧瓶中(装置见下图)加入一定量
溶液:在烧瓶中(装置见下图)加入一定量 和水,搅拌,通入
和水,搅拌,通入 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知 )。
)。

 尽可能转化完全,在通入
尽可能转化完全,在通入 比例一定、不改变固液投料的条件下,可采取的合理措施有__________________、__________________。
比例一定、不改变固液投料的条件下,可采取的合理措施有__________________、__________________。 换成空气,测得反应液中
换成空气,测得反应液中 的浓度随反应时间t变化如上图。导致溶液中
的浓度随反应时间t变化如上图。导致溶液中 浓度变化产生明显差异的原因是__________________。
浓度变化产生明显差异的原因是__________________。 固体:已知
固体:已知 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解; 开始沉淀时
开始沉淀时 。
。 溶液制备高纯
溶液制备高纯 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂: ]。
]。 查看答案和解析>>
科目: 来源:专项题 题型:实验题
 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以 为原料制备少量高纯
为原料制备少量高纯 的操作步骤如下
的操作步骤如下

 溶液:在烧瓶中(装置见上图(左))加入一定量
溶液:在烧瓶中(装置见上图(左))加入一定量 和水,搅拌,通入
和水,搅拌,通入 和
和 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知 )。
)。 尽可能转化完全,在通入
尽可能转化完全,在通入 和
和 比例一定、不改变固液投料的条件下,可采取的合理措施有__________________、_____________________。
比例一定、不改变固液投料的条件下,可采取的合理措施有__________________、_____________________。 换成空气,测得反应液中
换成空气,测得反应液中 的浓度随反应时间t变化如上图(右)。导致溶液中
的浓度随反应时间t变化如上图(右)。导致溶液中 浓度变化产生明显差异的原因是________________________。
浓度变化产生明显差异的原因是________________________。 固体:已知
固体:已知 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解; 开始沉淀时,
开始沉淀时, 。请补充由(1)制得的溶液制备高纯的操作步骤[实验中可选用的试剂:
。请补充由(1)制得的溶液制备高纯的操作步骤[实验中可选用的试剂: ]。
]。查看答案和解析>>
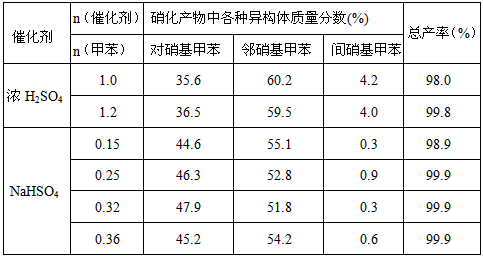
科目: 来源:专项题 题型:实验题

查看答案和解析>>
科目: 来源:0119 竞赛题 题型:实验题
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg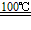 HgBr2+H2
HgBr2+H2  HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑ 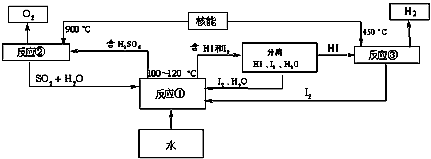

查看答案和解析>>
科目: 来源:高考真题 题型:实验题
查看答案和解析>>
科目: 来源:广东省高考真题 题型:实验题


查看答案和解析>>
科目: 来源:山东省高考真题 题型:实验题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及
CaCO3,步骤如下

请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为
___________(填代号),检验溶液A中Fe3+的最佳试剂为_______________(填代号)。
a、KMnO4 b、(NH4)2S C、H2O2 d、KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、__________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是____________________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)_______________(填化学式)。若实验过程中有氨气逸出,应选用下列_________装置回收(填代号)。
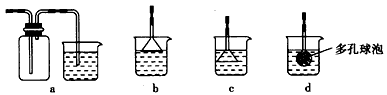
查看答案和解析>>
科目: 来源:浙江省高考真题 题型:实验题
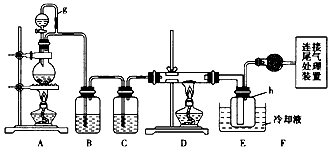
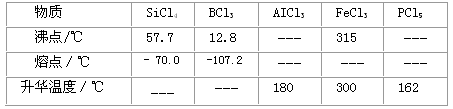
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com