
科目: 来源:福建省模拟题 题型:实验题
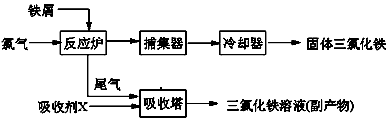
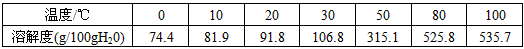
查看答案和解析>>
科目: 来源:0111 模拟题 题型:实验题
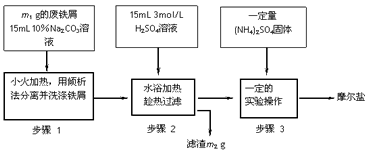
查看答案和解析>>
科目: 来源:期末题 题型:实验题
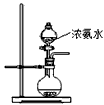
查看答案和解析>>
科目: 来源:0118 模拟题 题型:实验题
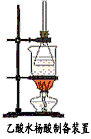


查看答案和解析>>
科目: 来源:山东省模拟题 题型:实验题
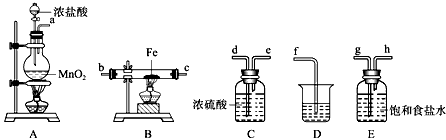
查看答案和解析>>
科目: 来源:0112 期中题 题型:实验题
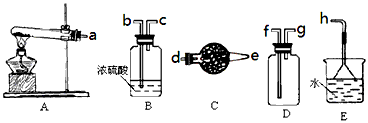
| 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成(S2Cl2),某化学研究性学习小组查阅了有关资料,得到如下信息: ①将干燥的氯气在110℃~140℃与硫反应,即可得粗品。 | ||||||||||||
| ②有关物质的部分性质如下表: | ||||||||||||
| ||||||||||||
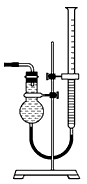
| 设计实验装置图如下: | ||||||||||||
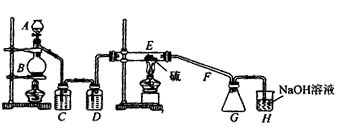 | ||||||||||||
| (1)图中气体发生和尾气处理装置不够完善,请提改进意见。_______________________________ 利用改进后的正确装置进行实验,请回答下列问题: (2)B中反应的离子方程式:___________________; E中反应的化学方程式:____________________。 (3)C、D中的试剂分别是_________________,_____________________。 (4)如果在加热E时温度过高,对实验结果的影响是_______________________,在F中可能出现的现象是______________________。 (5)S2Cl2粗品中可能混有的杂质是(填写两种) __________________________,为了提高S2Cl2的纯度,关键的操作是控制好温度和__________________。 |
查看答案和解析>>
科目: 来源:上海模拟题 题型:实验题
查看答案和解析>>
科目: 来源:江苏模拟题 题型:实验题

查看答案和解析>>
科目: 来源:安徽省模拟题 题型:实验题

查看答案和解析>>
科目: 来源:0103 期末题 题型:实验题
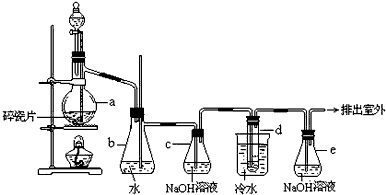
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com