
科目: 来源: 题型:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。

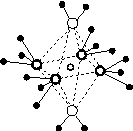
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。

(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。

(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
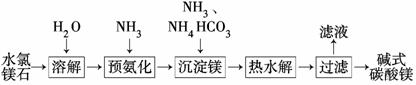
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol/L,则溶液中c(Mg2+)=_____ ___。
___。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为________。
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数________(填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol/L)如图所示。

(1)pH=3时溶液中铜元素的主要存在形式是__________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH______________。
A.<1 B. 4左右 C.>6
4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“ 能”或“不能”)通过调节溶液pH的方法来除去,理由是
能”或“不能”)通过调节溶液pH的方法来除去,理由是
_________________________________________________________________。
(4)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目: 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
CrO
 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O 和CrO
和CrO 的浓度相同
的浓度相同
b.2v(Cr2O )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O 离子,需要________mol的FeSO4·7H2O。
离子,需要________mol的FeSO4·7H2O。
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
(5)用Fe做电极的原因为_____________________ _______________________。
_______________________。
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________,溶液中同时生成的沉淀还有________。
查看答案和解析>>
科目: 来源: 题型:
利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3?(用离子方程式表示)________________________________________________________________________。
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
a.5 mL 水;
b.40 mL 0.2 mol/L 的Ba(OH)2溶液;
c.20 mL 0.5 mol/L的Na2SO4 溶液;
d.40 mL 0.1 mol/L 的H2SO4 溶液中,溶解至饱和。
①以上各溶液中,Ba2+的浓度由大到小的顺序为________。
A.b>a>c>d B.b>a>d>c
C.a>d>c>b D.a>b>d>c
②已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液b中的SO 浓度为________ mol/L,溶液c中Ba2+的浓度为________ mol/L。
浓度为________ mol/L,溶液c中Ba2+的浓度为________ mol/L。
③某同学取同样体积的溶液b和溶液d直接混合,则混合液的pH为________(设混合溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目: 来源: 题型:
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似)。如:
AgX(s) Ag++X-,Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag++X-,Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s)  Ag++Y-,Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag++Y-,Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)  Ag++Z-,Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag++Z-,Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
下列说法错误的是( )
A.这三种物质在常温下溶解度最大的是AgZ
B.将AgY溶解于水后,向其中加入AgX,则c(Y-)减小
C.在25℃时,取0.188 g AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中c(Y-)=1.0×10-4 mol/L
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
查看答案和解析>>
科目: 来源: 题型:
已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确 的是( )
的是( )
A.AgCl在饱和NaCl溶液中的Ksp和在纯水中的Ksp相同
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为浅黄色,说明Ksp(AgCl)<Ksp(AgBr)
C.将0.001 mol/L的AgNO3溶液滴入0.001 mol/L的KCl和0.001 mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
查看答案和解析>>
科目: 来源: 题型:
下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
查看答案和解析>>
科目: 来源: 题型:
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法错误的是( )
A.向该溶液中加入少量铁粉不能观察到红色固体析出
B.该溶液中c(SO )∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
C.向该溶液中加入适量氯水,并调节pH到3~4后过滤,得到纯净的CuSO4溶液
D.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com