
科目: 来源: 题型:
下列离子方程式书写正确的是
A.将少量SO2气体通入NaClO溶液中 SO2 +2ClO-+H2O = SO32-+2HClO
B.向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2+ +OH-+ H++ SO42- = BaSO4↓+ 2H2O
C.向Ca(H2PO4)2溶液中滴入过量的NaOH溶液 3Ca2+ + 6H2PO4-+12OH-= Ca3(PO4)2↓+ 4PO43-+12H2O
D.112mL(标况)Cl2通入10mL1mol/L的FeBr2溶液中 2Fe2+ + 4Br-+3Cl2 = 2Fe3+ + 6Cl-+2Br2
查看答案和解析>>
科目: 来源: 题型:
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
①常温常压下,9g甲烷(CH4)所含的中子数为5NA
②常温常压下,22.4L N2气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气分子含有的核外电子数为4NA。
A.①② B.②④ C.③④ D.⑤⑥
查看答案和解析>>
科目: 来源: 题型:
 A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.丙图装置可制得金属锰,用同样的装置可制得金属铬
D.丁图验证NaHCO3和Na2CO3热稳定性
查看答案和解析>>
科目: 来源: 题型:
经测定某种溶液中只含 四种离子,下列说法错误的是( )
四种离子,下列说法错误的是( )
A.若满足: ,则溶质一定是
,则溶质一定是
B.若满足: ,则溶质一定是
,则溶质一定是 和
和
C.溶液中四种离子之间可能满足:
D.若满足: ,则溶液一定呈中性
,则溶液一定呈中性
查看答案和解析>>
科目: 来源: 题型:
下列有关实验操作说法中,正确的是
①用pH试纸测得氯水的pH为2
②用量筒、试管胶头滴管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的硫酸和醋酸
③在进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体
A.①③⑤ B.②③⑤ C.③④⑤ D.①③④⑥
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A、为防止富脂食品氧化变质可以在包装袋中加入生石灰
B、用医用酒精消毒是因为酒精可以使蛋白质发生盐析
C、绿色食品是不含任何化学物质的食品
D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来
查看答案和解析>>
科目: 来源: 题型:
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。
现测出肉桂酸甲酯的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:

试回答下列问题。
(1)肉桂酸甲酯的结构简式为 。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示:
(图中球与球之间连线表示单键或双键)。
用芳香烃A 为原料合成G的路线如下:

① 化合物E中的官能团有 (填名称)。
② A→B的反应类型是 ,E→F的反应类型是 ,
③ 书写化学方程式
B→C
C→D
E→H
④ 其中E的同分异构体甚多,其中有一类可用通式 表示
(其中X、Y均不为H),
试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
、
、
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.下列有关说法不正确的是___ _____。
_____。
A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定
B.NH3和H3O+是等电子体,因此结构都是三角锥形
C.邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在
分子间氢键
D.H3O+、HF2-和[Ag(NH3)2]+中均存在配位键
Ⅱ.碳及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为 。第四周期与其有相同
未成对电子数的过渡金属有 (填元素符号)
(2)第一电离能:C、N、O、F四种元素由大到小顺序___ _ ,
原因是 ,
HCN、NF3分子构型分别是 。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子中心间的最短距离为
d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
查看答案和解析>>
科目: 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
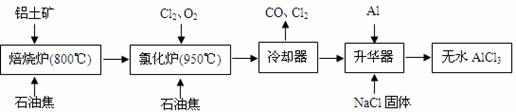
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是 晶体,其结构式为 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
查看答案和解析>>
科目: 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____ (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com