
科目: 来源: 题型:
某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
(1)探究温度对化学反应速率影响的组合实验编号是__________(填编号,下同);探究反应物浓度对化学反应速率影响的组合实验编号是__________。
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A. 读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B. 滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C. 盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D. 盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
查看答案和解析>>
科目: 来源: 题型:
H2可以催化还原NO以达到消除污染的目的:
(1)已知:①

②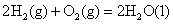
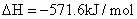
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为: ________________。
(2)一定条件下,在体积为2 L的容器中通入1 mol H2和l mol NO气体生成N2(g)和H2O(l),该反应达平衡时,容器内的压强是反应起始时的40%。保持其它条件不变,只往容器中再通入1 mol H2,计算反应再达新平衡时,化学平衡常数为__________。
查看答案和解析>>
科目: 来源: 题型:
元素Cu的一种氯化物晶体的晶胞结构如图所示,计算推出该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为____________________。

查看答案和解析>>
科目: 来源: 题型:
按下图装置进行实验,回答下列问题(C、C1、C2均为石墨电极)。

(1)铁电极为__________极,电极反应式为__________;
(2)石墨棒C1为__________极,石墨棒C2附近的实验现象为____________________。
(3)当C2极产生2.24 L气体(标准状态)时,A中CuSO4溶液的质量改变了__________g。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有3个电子。
(1)C原子的基态电子排布式为__________;若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式分类,A与C形成的最简单化合物中的共价键属于__________键。
(2)当n=2时,元素A在周期表中的位置是__________,B与C形成的化合物的VSEPR模型名称为__________形。
(3)当n=3时,B与C形成的晶体类型是__________,此时A、B、C、D四种元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
查看答案和解析>>
科目: 来源: 题型:
化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | ____________ |
| ③用H2O2分解制O2时,加入MnO2 | ____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |
(2)一定温度下,在2L体积不变的密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示:
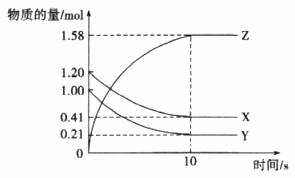
①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
查看答案和解析>>
科目: 来源: 题型:
按要求填写空白:
(1)写出醋酸钠在水中发生水解反应的离子方程式:____________。
(2)浓度均为0.1mol/L的下列4种物质的水溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
pH由大到小的顺序是_________(填数字序号)。
(3)在①H2O ②HCHO ③Cl2 ④C2H2 ⑤CCl4分子中:
全部以非极性键结合的非极性分子是_________(填数字序号,下同);
全部以极性键相结合,具有V形分子立体构型的是________;
中心原子为sp3杂化的非极性分子是_________;
中心原子为sp2杂化的极性分子是________;
既有极性键又有非极性键的非极性分子是_____________。
查看答案和解析>>
科目: 来源: 题型:
用相同浓度的标准盐酸滴定相同体积、相同pH的 、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
A. V3>V2>V1 B. V3=V2=V1 C. V1=V2>V3 D. V3>V2=V1
查看答案和解析>>
科目: 来源: 题型:
一定条件下,在体积为10L的密闭容器中,1 molX和1 molY发生反应: 2x(g)+Y(g) Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
A.反应进行30 s时,正反应速率等于逆反应速率
B.反应进行80 s时,逆反应速率大于正反应速率
C.反应进行60 s时,X的物质的量浓度为0.04 mol/L
D.反应进行60 s时,Y的转化率为70%
查看答案和解析>>
科目: 来源: 题型:
下列各组物质中,酸性由强到弱的排列顺序错误的是
A.HClO H2CO3 CH3COOH B.HClO4 HClO3 HClO2
C.HClO4 H2SO4 H3PO4 D.HClO4 HBrO4 HIO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com