
科目: 来源:不详 题型:问答题
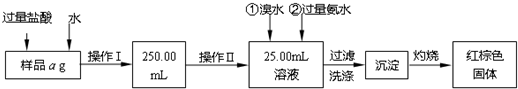
查看答案和解析>>
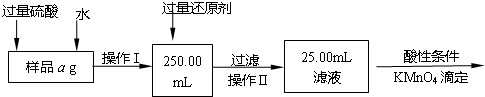
科目: 来源:不详 题型:问答题
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应1 | Au+6HNO3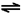 Au(NO3)3+3NO2↑+3H2O |
<10-5 |
| 反应2 | Au3++Cl-  [AuCl4]- |
>105 |
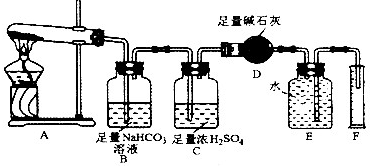
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 实验方案 | 可能的现象和相应的结论 |
| 将混合气体依次通过盛有______、______、______的洗气瓶. |
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:填空题
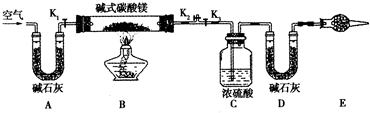
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 化合物 | A | B | C |
| w(X) | 0.077 9 | 0.237 6 | 0.75 |
| w(Y) | 0.922 1 | 0.703 | 0 |
| 常压下T℃时的密度(g/cm3) | 1.594 7(20℃) | 2.254 5×10-3(0℃) | 0.668×10-3(20℃) |
| 沸点/℃ | 76.8 | -23.7 | -161.49 |
| 熔点/℃ | -22.95 | -97 | -182.48 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 结论 | 理由 | |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com