
科目: 来源: 题型:
某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物; ②天然气和水蒸气都是可再生能源; ③冰和干冰既是纯净物又是化合 物;④不锈钢和目前流通的硬币都是合金; ⑥盐酸和食醋既是化合物又是酸; ⑥纯碱和熟石灰都是碱; ⑦豆浆和雾都是胶体。上述说法正确的是
物;④不锈钢和目前流通的硬币都是合金; ⑥盐酸和食醋既是化合物又是酸; ⑥纯碱和熟石灰都是碱; ⑦豆浆和雾都是胶体。上述说法正确的是
A.①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
查看答案和解析>>
科目: 来源: 题型:
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.国庆节期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩
B.小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
查看答案和解析>>
科目: 来源: 题型:
硼是一种重要的非金属元素,单质硼可以通过硼镁矿(主要成分为Mg2B2O5·H2O)来制取。
第①步:将硼镁矿用NaOH浓溶液溶解,过滤得NaBO2溶液
第②步:将NaBO2 浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7·10H2O
第③步:将硼砂溶于水后,用H2SO4调节碱度,过滤得H3BO3 晶体
第④步:加热硼酸使之脱水生成B2O3。
第⑤步:B2O3用镁还原即得粗单质硼。
请回答下列问题:
(1)已知H3BO3 分子中只含B—O键和O—H键,则H3BO3 的结构式为___________。
(2)第①步反应的化学方程式为_______________________________________;
第③步反应的离子方程式为____________________________________________。
(3)制得的粗硼在一定条件下反应全部化成BI3,然后BI3热分解可以得到纯净的单质硼。由0.25g粗硼制成的BI3分解得到I2全部被收集后,用1.80mol·L-1的Na2S2O3溶液滴定,用去35.00mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O52-)
①盛装Na2S2O3溶液的为____________(填“酸式”或“碱式”)滴定管,滴定过程中所用的指示剂为________________。
②粗硼中硼的含量为__ ________________。
________________。
查看答案和解析>>
科目: 来源: 题型:
己二酸是一种重要的有机二元 酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
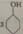 +8HNO3
+8HNO3 3HOOC(CH2)4COOH+8NO
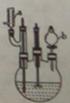
3HOOC(CH2)4COOH+8NO +7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
+7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
实验步骤:
I.在60mL三颈烧瓶中加入16.0mL50%硝酸(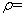 1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
II.首先将瓶内液体加热到50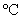 左右,开动搅拌器,滴入环己醇(
左右,开动搅拌器,滴入环己醇(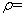 0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90
0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90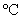 左右水浴加热20分钟,至反应完毕。
左右水浴加热20分钟,至反应完毕。
III.趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重。
IV.将粗产品在水中进行重结晶操作。
请回答下列问题:
(1)仪器a的名称是_________________。仪器b在使用前应_________________。
(2)偏钒酸铵的作用是_______________。
(3)反应完成后,趁热倒出反应液的目的是___ ________________
________________ 。
。
(4)本实验中己二酸的理论产量为______________g。
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3=2NaNO2+NaNO3+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2 时,吸收液 质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
查看答案和解析>>
科目: 来源: 题型:
无机化合物A中含有元素Li元素,A的摩尔质量23g·mol-1,A主要用于有机合成和药物制造,同时也是良好的储氢材料。在一定条件下,0.1mol固体A与0.1molNH4Cl固体恰好完全反应,生成固体B和4.48L(标准状况)气体C。已知气体C极易溶于水,且得到碱性溶液。电解无水B可生成金属单质D和氯气。请回答下列问题:
(1)A的化学方式是_________________________。
(2)写出化合物A与NH4Cl反应的化学方程式:_______________________________。
(3)某同学通过查阅资料得知物质A的性质:
I.工业上可用金属D与液态的C在硝酸铁催化下反应来制备A物质。
II.物质A遇水强烈水解,释放出气体C。
①I中发生反应的基本反应类型是__________________________。
②物质A遇水强烈水解的化学方程式为_________________________。
(4)工业制备单质D的流程如下:
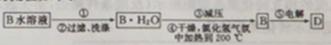
①步骤①中操作的名称为________________。
②试用平衡原理解释步骤③中减压的目的是:_________________________。
查看答案和解析>>
科目: 来源: 题型:
兰尼镍(Rancy-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,广泛用作烯烃、氢化反应的催化剂。其高催化活性源于镍本身的催化性质和其多孔结构对氢气的强吸附性。以镍、铝为原料制备兰尼镍的工艺流程如下:
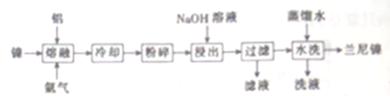
(1)“熔融”时通入氩气的目的是_____________________________________。
(2)“浸出”是整个流程的核心步骤,该步骤的目的是_____________________,发生反应的离子方程式为____________________________________。浸出反应所用NaOH溶液的浓度需达5mol·L-1以上,若用NaOH稀溶液浸出时,则会产生Al(OH)3沉淀阻止浸出反应持续进行,产生Al(OH)3的化学方程式为___________________________。
(3)滤液的主要成分与过量CO2反应的离子方程式为__________________。
(4)使用新制的兰尼镍进行氢化反应有时不需要加入氢气即可完成反应得到氢化产物,原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
1814年戴维发现了一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。
(1)氯元素在元素周期表中的位置是_________;ICl的电子式为____________。
(2)ICl与冷的NaOH稀溶液反应的离子方程式为____________________。
(3)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,发生化学反应的化学方程式为_____________________。
(4)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_________________________。下列说法正确的是______。
a.ICl3分子中各原子均达到8电子稳定结构
b.由反应KClO3+I2+6HCl=2ICl3+KCl+3H2O,可知还原性:KClO3>ICl3
c.ICl与乙烯反应的化学方程式为CH2=CH2+ICl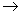 ICH2CH2Cl
ICH2CH2Cl
d.ICl与苯反应制取碘苯的化学方程式为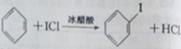
查看答案和解析>>
科目: 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5)是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为试样的pH=______。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: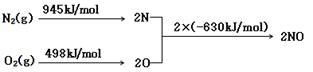
则反应N2(g)+O2(g) 2NO(g)
2NO(g) 
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
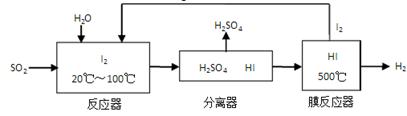
①用离子方程式表示反应器中发生的反应:__________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)2+M NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充
NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充 电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
查看答案和解析>>
科目: 来源: 题型:
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法正确的是
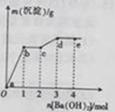
A. 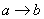 时的沉淀成分为BaSO4与Mg(OH)2
时的沉淀成分为BaSO4与Mg(OH)2
B. 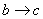 时发生的离子反应为H++OH-=H2O
时发生的离子反应为H++OH-=H2O
C. c点时的溶液中
D. 原混合溶液中:n(HCl)=2mol
查看答案和解析>>
科目: 来源: 题型:
工业上消除氮氧化物的污染可用如下反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g) 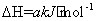
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如下表:
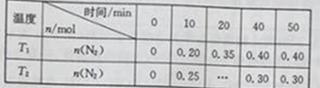
下列说法不正确的是
A. 10 min内,T1时的v(N2)比T2时的小
min内,T1时的v(N2)比T2时的小
B. T1<T2
C. a<0
D. T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com