
科目: 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②④
C.②③④ D.①④
查看答案和解析>>
科目: 来源: 题型:
某稀硫酸和硝酸的混合溶液200 mL,分成两份。向其中一份逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO)。向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如下图所示。

(1)第一份溶解铜粉的离子方程式
(2)第二份溶液中最终溶质为 ;BC段产生的气体是 (填化学式),
(3)AB段的反应的化学方程式为 ;
(4)原混合酸中HNO3的物质的量为 mol,
H2SO4的物质的量浓度应为 mol/L
查看答案和解析>>
科目: 来源: 题型:
据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为 (填元素名称)
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
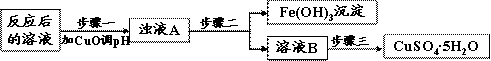
①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
步骤一应调节溶液的pH范围是 ,请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因
②步骤三中的具体操作方法是
(3)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH
已知:①2Cu(s)+1/2O2(g)=Cu2O(s) ΔH=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s) ΔH=-79.5kJ/mol
③S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
则该法冶炼铜的反应中ΔH= 。
查看答案和解析>>
科目: 来源: 题型:
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。

(1)仪器名称:d ;e
(2)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电式 。
(3)装置a中应放试剂为 ,f装置中试剂的作用
(4)该实验的操作顺序应为 (用序号表示)。
①加热装置C ②通入Cl2 ③通入冷水 ④停止通Cl2 ⑤停止加热装置C
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:

(1).此流程的第Ⅱ步反应为:CO(g)+H2O(g)  H2(g)+CO2(g),该反应的化学平衡常数表达式为K=___________ _ ;反应的平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=___________ _ ;反应的平衡常数随温度的变化如表所示。
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O分别为2mol和3mol,则达到平衡后CO的转化率为________。
Ⅱ.有A、B、C、D四种无色溶液,它们分别是一定浓度的①Na2SO4溶液、②氨水、③盐酸、④AlCl3溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。请回答下列问题:
(2) B是________, D是________。(填序号)
(3).写出足量B溶液与少量C溶液混合后发生反应的离子方程式:
___________________________________。
(4).A、B溶液等体积混合后,溶液中各离子浓度由大到小的顺序是:___________________
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
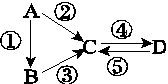
(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质,写出
反应④的化学方程式__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式: __________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。简述检验溶液D中金属阳离子的操作方法及现象:
查看答案和解析>>
科目: 来源: 题型:
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如图

下列分析不正确的是
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目: 来源: 题型:
日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3 +3O2 =2CO2 +3H2O ,电池示意如右图,下列说法正确的是:
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:4H++ O2 +4e—= 2H2O
D.电池工作时,1mol二甲醚被氧化时就有6mol电子转移
查看答案和解析>>
科目: 来源: 题型:
近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化……将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因。某研究小组研究某地硫酸型酸雨的形成,有人提出以下猜想:
猜想一:




猜想二:




猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是
A.若猜想一或猜想三正确,该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成
B.若只存在猜想二的过程,则该雨水的pH随时间延长而增大
C.若存在猜想二的过程,则该雨水可能使品红溶液褪色
D.上述任意一个猜想正确,该地区雨水的pH均小于5.6
查看答案和解析>>
科目: 来源: 题型:
由一种阳离子与两种酸根离子组成的盐为混盐。混盐CaOCl2在酸性条件下可以产生Cl2下列关于混盐CaOCl2的有关判断正确的是
A.该混盐具有和漂白粉相似的化学性质
B.该混盐的水溶液呈中性
C.该混盐与硫酸反应产生1 mol Cl2时转移2 mol电子
D.该混盐中氯元素的化合价为-1价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com