
科目: 来源: 题型:
【化学—选修5:有机化学基础】(15分)
化合物G的合成路线如下:
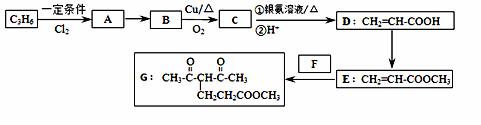
(1)D中含氧官能团的名称为 ,1 mol G发生加成反应最多消耗 mol H2 。
(2)除掉E中含有少量D的试剂和分离方法分别是 , ;
(3)下列说法正确的是 (填字母序号)。
a.A易溶于水
b.只用溴水即可确定C中含有碳碳双键
c.E经加聚、碱性条件下水解,所得高聚物可做具有高吸水性能的树脂
d.E是CH2=CHCOOCH2CH3的同系物
(4)写出A→B的化学反应方程式 ;
写出C和银氨溶液反应的离子方程式 。
(5)反应E + F→ G属于下列麦克尔加成反应类型,则F的结构简式为 。

(6)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式 。
查看答案和解析>>
科目: 来源: 题型:
【化学一选修3:物质结构与性质】(15分)
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关。
(1)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,理由是 。
(2)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态碳原子的电子排布图 ,该物质的K原子和C60分子的个数比为 。
(3)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
(4)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式 ;两者相比较沸点高的为
(填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为 。
(5)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个Ni原子之间的最短距离为___________m(精确至0.01)。若晶体中的Ni分别为Ni2﹢、Ni3﹢,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
查看答案和解析>>
科目: 来源: 题型:
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
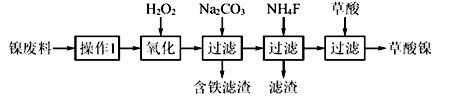
(1)操作1为 。
(2)生产过程中多次进行过滤,实验室进行过滤操作中需用到玻璃棒,下列实验操作中哪些操作中玻璃棒的作用完全相同的是 (填选项字母)。
①配制0.1mol/L的H2SO4溶液
②测定Na2CO3溶液的pH
③用KI淀粉试纸检验溶液中的氧化性离子
④加热食盐溶液制备NaCl晶体
⑤配制20%的KNO3溶液
A.①⑤ B.②③ C.④⑤ D.①④
(3)加入H2O2发生的主要反应的离子方程式为 ;
加入Na2CO3溶液调pH至4.0~4.5,其目的为 ;
加入NH4F后除掉的杂质是 。
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为 。
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(6)电解法制取Ni2O3的实际过程中,有时获得一种结晶水合物,已知含1molNi的该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,获得Ni2O3固体和0.2mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
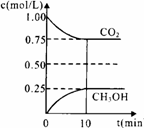 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
①能说明该反应已达平衡状态的是 。
A. CO2的体积分数在混合气体中保持不变
B. 混合气体的平均相对分子质量不随时间的变化而变化
C. 单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D. 反应中H2O与CH3OH的物质的量浓度之比为1:1,且 保持不变
②下列措施中能使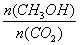 增大的是 (选填编号)。
增大的是 (选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K= 。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
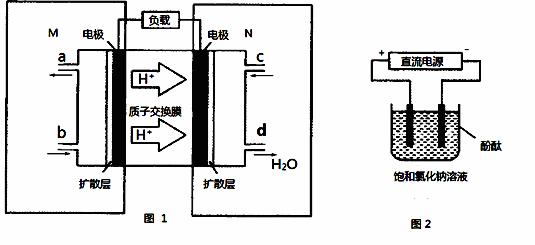
①M区发生反应的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为
(忽略溶液体积变化)。
(3) 有一种用CO2生产甲醇燃料的方法:
已知: CO2(g)+3H2(g)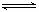 CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为: 。
查看答案和解析>>
科目: 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,可用做肥料、灭火剂、洗 涤剂等。制备氨基甲酸铵的化学方程式如下:2NH3(g)+CO2(g) NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
a.常温下在干燥的空气中稳定,遇水生成碳酸铵或碳酸氢铵;
b. 59℃则可分解成NH3和CO2气体;
用如图I装置制备干燥的氨气,图II装置制备氨基甲酸铵,把制备的干燥的氨气和二氧化碳通入四氯化碳中不断搅拌混合,当生成的氨基甲酸铵晶体悬浮在四氯化碳中较多时停止制备(注:四氯化碳与液体石蜡均为惰性介质)。
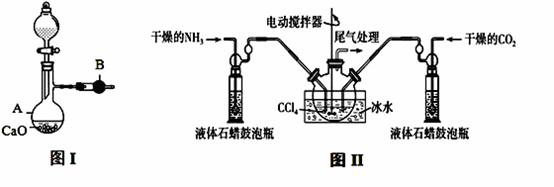
请回答下列问题:
(1)图I中,仪器B的名称 , A中的化学反应方程式是 ;
(2)图II装置中使用冰水的原因是 ;
(3)图II中液体石蜡鼓泡瓶的作用是 ;
(4)从图II反应后的混合物中分离出产品的方法是 ;
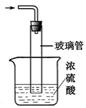 A.蒸馏 B.过滤 C.分液 D.结晶
A.蒸馏 B.过滤 C.分液 D.结晶
(5)图II装置中,尾气处理装置如右图所示,玻璃管的作用 ,浓硫酸的作用是 和防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品7.82 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为10.0 g,则样品中氨基甲酸铵的质量分数为 (计算结果精确至0.1%)
查看答案和解析>>
科目: 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示:
(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为 ;
若生成102g Al2O3,转移的电子数目为 ;
(2)生成沉淀Ⅰ时的离子方程式为 ;
(3)写出化学式:沉淀Ⅱ是 ;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 ;
(5)从滤液中得到K2SO4晶体的方法是 ;
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
现有Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准 KMnO4溶液V2mL
B. 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为cg
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测定干燥管I增重dg
查看答案和解析>>
科目: 来源: 题型:
下列解释事实的化学方程式或离子方程式正确的是
A. 以MnO2为原料制得的MnCl2溶液中常含有Cu2+等金属离子,通常添加难溶电解质MnS使这些离子形成硫化物沉淀而除去:Cu2+ + S2-=CuS↓
B. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH- = SiO32- + H2O
C. 金属钠在空气中放置表面会很快失去金属光泽:2Na + O2 = Na2O2
D. 向硫酸亚铁铵[(NH4)2Fe(SO4) 2·6H2O]的稀溶液中加入足量Ba(OH) 2稀溶液:
NH4+ + Fe2+ + SO42-+ Ba2+ +3OH- = BaSO4↓+ Fe(OH) 2↓+ NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:
4OH— — 4e— == O2↑+2H2O
B. 为了提高Ni的产率,电解过程中需要控制废水pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目: 来源: 题型:
已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11。向0.1mol/LNaOH溶液中通入CO2,若溶液的pH=10(不考虑溶液的体积变化),则下列说法正确的是
A. 2c(CO32-)+c(HCO3-)=0.1mol/L
B. 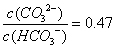
C. 该溶液中加BaCl2溶液,溶液pH增大
D. 在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com