
科目: 来源: 题型:
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目: 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。
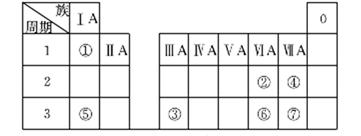
(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
科目: 来源: 题型:
有一瓶无色溶液,其中可能含有NH4+、K+ 、Mg2+、Ba2+、Al3+ 、Fe3+、I-、Cl-、NO3-、CO32-、SO42-取该溶液进行以下实验:
①该溶液可使pH试纸呈红色;
②取少量溶液加新制氯水及CCl4振荡,可见CCl4层呈现紫色;
③取少量溶液加氯化钡溶液,有白色沉淀生成,加人HNO3后沉淀不溶解;
④取实验③之上层清液,加入硝酸银溶液有白色沉淀生成,加入HNO3后沉淀不溶解;
⑤取少量原溶液加入NaOH溶液呈碱性,在此过程中有白色沉淀生成,而后又逐渐消失,将此溶液加热,有无色气休放出,该气体能使润湿的红色石蕊试纸变蓝。
根据上述实验事实,溶液中肯定存在的离子有_____________________,肯定不存在的离子有_____________________,不能确定是否存在的离子有_________________________。
查看答案和解析>>
科目: 来源: 题型:
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A. 66.4 g B.50.8 g C 44.8g D. 39.2 g
查看答案和解析>>
科目: 来源: 题型:
下列各组物质的性质比较中,正确的是
A.酸性:HClO4>H3PO4>H2SO4 B.氢化物的稳定性:H2S>HF>H2O
C.碱性:Al(OH)3>Mg(OH)2>NaOH D.氧化性:F2>C12>Br2>I2
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,4 gCH4含有NA个C-H共价键
B. 1 mol Fe与足量稀HNO3反应,转移2NA个电子
C.1 L 0. 1 mol/L NaHCO3溶液中含有0. 1NA个HCO3-
D.常温常压下,22.4 LNO2和CO2的混合气体中含有2NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
查看答案和解析>>
科目: 来源: 题型:
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是
A.H+、Ba2+、Fe3+、NO3-,通入SO2气体
B.Ca2+、Cl-、K+、H+,通入CO2气体
C.AlO2-、Na+、Br-、SO42-,通入CO2气体
D.HCO3-、Na+、I-、HS-,加入AlCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com