
科目: 来源: 题型:
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目: 来源: 题型:
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO42-
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3-
C.使甲基橙变红色的溶液中:Fe2+、K+、NO3-、SO42-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
化学与环境、材料、信息、能关系密切,下列说法正确的是
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.绿色化学的核心是利用化学原理治理环境污染
C.将煤气化或液化,获得清洁燃料
D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应
查看答案和解析>>
科目: 来源: 题型:
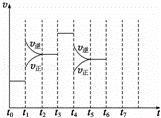
在一密闭容器中发生反应N2+3H2⇌2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是 ACDF (填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 A (填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线.
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 5:6 .
查看答案和解析>>
科目: 来源: 题型:
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
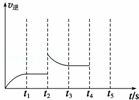
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.
查看答案和解析>>
科目: 来源: 题型:
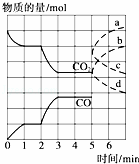
在一个体积为2L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)⇌FeO(s)+CO(g).其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示.
(1)反应在1min时第一次达到平衡状态,固体的质量增加了3.2g.用CO2的浓度变化表示的反应速率v(CO2)= 0.1mol•L﹣1•min﹣1 .
(2)反应进行至2min时,若只改变温度,曲线发生的变化如图所示,3min时再次达到平衡,则△H > 0(填“>”、“<”或“=”).
(3)5min时再充入一定量的CO(g),平衡发生移动.下列说法正确的是 c (填写编号).
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是 b (填写图中曲线的字母编号).
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态: 固体总质量保持不变 .
查看答案和解析>>
科目: 来源: 题型:
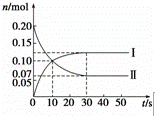
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2⇌2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
①图象中曲线 Ⅰ (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是 放 热反应(选填“吸”或“放”).
③在800℃时,若缩小容器的体积,达新平衡时n(NO) < (选填“>”、“=”或“<”)0.07mol,NO的转化率 增大 (选填“增大”、“不变”或“减小”).
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)⇌SiO2(s)
+4HF(g)△H=+148.9kJ•mol﹣1.
①下列各项中能说明该反应已达化学平衡状态的是 bcd (填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.通过a或b的值及化学平衡原理判断t1时反应是否达到化学平衡状态: t1时反应已经达到化学平衡状态 .
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目: 来源: 题型:
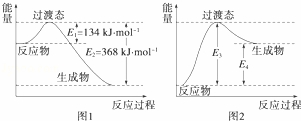
过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图1是1mol NO2与1mol CO恰好反应生成CO2和NO过程中的能量变化示意图.
(1)试写出NO2和CO反应的热化学方程式: NO2(g)+CO(g)═NO(g)+CO2(g)△H=﹣234kJ•mol﹣1 .该反应的活化能是 134 kJ•mol﹣1.
(2)在密闭容器中进行的上述反应是可逆反应,则其逆反应的热化学方程式为 NO(g)+CO2(g)═NO2(g)+CO(g)△H=+234kJ•mol﹣1 ,该反应的活化能为 368 kJ•mol﹣1.
(3)图2是某学生模仿图1画出的NO(g)+CO2(g)═NO2(g)+CO(g)的能量变化示意图.则图中E3= 368 kJ•mol﹣1,E4= 234 kJ•mol﹣1.
查看答案和解析>>
科目: 来源: 题型:
研究NO2、SO2、等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为 3NO2+H2O=NO+2HNO3 .利用反应6NO2+8NH3 7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
(2)已知:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H= ﹣41.8 kJ•mol﹣1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 b .
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com