
科目: 来源: 题型:
纯碱和小苏打是厨房中两种常见用品,下列区分它们的做法正确的是 ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,火焰颜色发生明显变化的是小苏打
C.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
D.用两只玻璃杯分别加入少量的两种样品,再加入等量的食醋,产生气泡速度快的是小苏打
查看答案和解析>>
科目: 来源: 题型:
下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾。试综合上述命名规律,分析回答:Na2CS3应读做( )
A.硫代碳酸钠 B.多硫碳酸钠 C.过硫碳酸钠 D.超硫碳酸钠
查看答案和解析>>
科目: 来源: 题型:
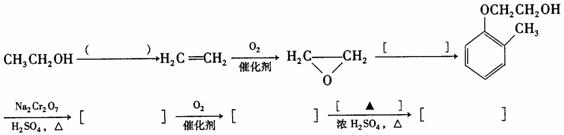
慢心律是一种治疗心律失常的药物,它的合成路线如下:
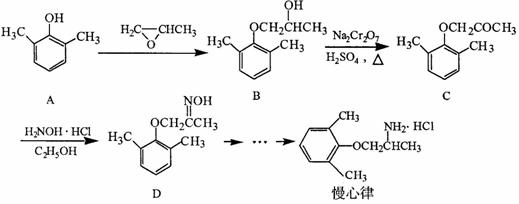
(1)由B → C的反应类型为 。
(2)B分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式: 。
①属于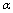 -氨基酸;
-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有一种。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷。
完成以邻甲基苯酚(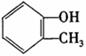 )和乙醇为原料制备
)和乙醇为原料制备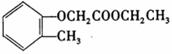 的合成路线流程图。
的合成路线流程图。
①结合题中信息;无机试剂任用。
②合成路线流程图中,在( )填反应条件,在[ ]填反应物或生成物的结构简式:
查看答案和解析>>
科目: 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
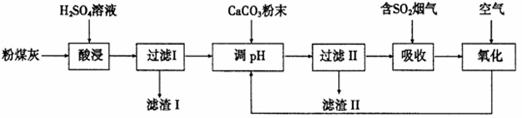
(1)酸浸时反应的化学方程式为 ;滤渣I的主要成分为 (填化学式)。
(2)滤渣Ⅱ的主要成分为 (填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为 。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为 ;氧化后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
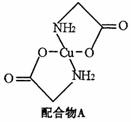
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有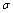 键的数目为 。
键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
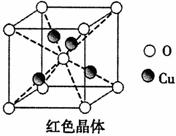
则该化合物的化学式是 。
查看答案和解析>>
科目: 来源: 题型:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1= - 90.7 kJ·mol-1
CH3OH(g) △H 1= - 90.7 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)右图为绿色电“二甲醚燃料电池”的工作原理示意图。
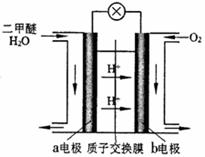
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
某科研小组设计出利用工业废酸(稀H2SO4)浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
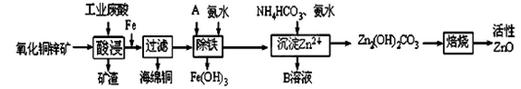
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的 。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(5)物质B可直接用作氮肥,则B的化学式是 。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1 可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1 。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中不正确的是
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 |
|
|
|
A.甲中反应的平衡常数小于乙 B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率: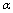 1<
1<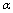 2 =
2 = 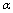 3 D.容器中SO3的物质的量浓度:丙=丁<甲
3 D.容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com