
科目: 来源:同步题 题型:实验题
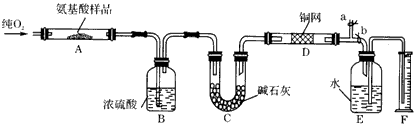
查看答案和解析>>
科目: 来源:期末题 题型:实验题

查看答案和解析>>
科目: 来源:0103 期末题 题型:实验题
某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管量取25 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
(1)正确操作步骤的顺序是_______(用字母表示)。
(2)观察滴定管液面的高度时应注意_____________________。
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是__________________________。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低” 或“无影响”),原因是:__________________。
(5)该烧碱样品纯度的计算式为_________________。
查看答案和解析>>
科目: 来源:0103 期中题 题型:单选题
查看答案和解析>>
科目: 来源:0103 期中题 题型:单选题
查看答案和解析>>
科目: 来源:0106 月考题 题型:实验题

查看答案和解析>>
科目: 来源:0101 月考题 题型:实验题
查看答案和解析>>
科目: 来源:专项题 题型:实验题
某实验小组采取如下步骤测定某苯酚样品的纯度。
步骤I.向反应器中加入KBrO3--KBr(KBr稍过量)混合溶液25 mL, 用稀硫酸酸化后有Br2生成;再加入过量KI溶液,有I2析出;用淀粉作指示剂,用0.1 mol/L Na2S2O3标准溶液滴定析出的I2,共用去Na2S2O3溶液40 mL。
(1)写出KBrO3--KBr混合溶液酸化后生成Br2的离子方程式_________________。
(2)用Na2S2O3,标准溶液滴定I2的反应如下,请配平该离子方程式:
①___I2+____S2O32-→_____I-+______S4O62-
②达到滴定终点时,溶液的颜色变化为_______________。
步骤Ⅱ.①将苯酚样品0.4g,溶于NaOH溶液,加水配成250 mL,量取25 mL置于另一反应器中。
②再加入与步骤I中相同的KBrO3--KBr混合溶液25mL,用稀硫酸酸化后有白色沉淀产生。
③继续加入过量KI溶液,生成的I2仍用0.1 mol/L的Na2S2O3标准溶液滴定,用去Na2S2O3溶液19 mL。
(3)写出②中苯酚转化成白色沉淀的化学方程式_____________________。
(4)综合步骤I、Ⅱ的实验数据,参与(3)反应的n(Br2)= ______________(只要求列出计算式)。
(5)该苯酚样品的纯度为__________________。
查看答案和解析>>
科目: 来源:专项题 题型:实验题
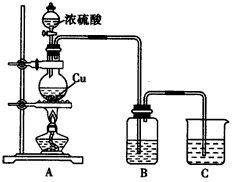


查看答案和解析>>
科目: 来源:0112 月考题 题型:实验题


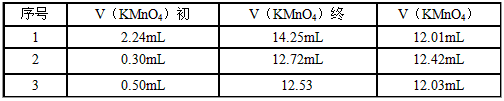
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com