
科目: 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C离子的原子结构示意图_______________;D在周期表的位置___________________。
(2)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)________________,以下三种说法中,可以验证该结论的是(填写编号)______________;
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素的原子显负价
c.比较这两种元素气态氢化物的稳定性
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),它们都含有的化学键类型是_________,这两种酸式盐在水溶液中相互反应的离子方程式为_______________________________。
(4)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,转移的电子数是___。
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的叙述中,合理的是__________
A实验室中少量金属钠、钾保存在汽油中
B容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水
C圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
D用一定浓度的盐酸滴定未知浓度的氢氧化钠溶液时,酸式滴定管记录起始体积时,平视读数,终点时俯视,所测碱的浓度偏高
E.不用其它化学试剂即可鉴别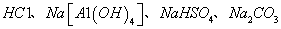 四种无色溶液
四种无色溶液
F.可以用渗析的方法除去淀粉溶液中的氯化钠
查看答案和解析>>
科目: 来源: 题型:
常温下,向l00 mL 0.01 mol/LHA溶液中逐滴加入0.02 mol/LMOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是
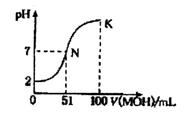
A.HA为一元强酸,MOH为一元强碱
B.K点所示溶液中c(A-)>c(M+)
C.N点水的电离程度小于K点水的电离程度
D.K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L
查看答案和解析>>
科目: 来源: 题型:
常温下,浓度均为0.1 mol/L的6种盐溶液pH如下:

下列说法正确的是
A. Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl
B.相同条件下电离程度比较:HCO3->HSO3->HClO
C.6种溶液中,Na2SiO3溶液中水的电离程度最小
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知: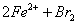 ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
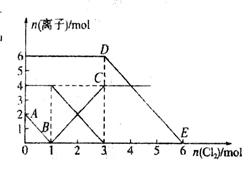
A.还原性:I->Fe2+>Br-
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n (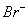 )=6 mol
)=6 mol
查看答案和解析>>
科目: 来源: 题型:
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:下列判断正确的是

A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、Al(OH)4-和SiO32-一定存在于溶液X中
D.CO32-和SO42-一定不存在于溶液X中
查看答案和解析>>
科目: 来源: 题型:
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| B | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 证明溶液中含有SO42- |
| C | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水 ,石灰水变浑浊 | 证明该溶液中存在CO32- |
| D | 向0.1mol•L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色 | 说明Fe2+具有氧化性 |
查看答案和解析>>
科目: 来源: 题型:
用铝制易拉罐收集满CO2,快速加入过量NaOH浓溶液,立即把口封闭。发现易拉罐“咔咔”作响,并变瘪了:过一会儿,易拉罐又会作响并鼓起来。下列说法正确的是
A.导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3-
B.导致易拉罐又鼓起来的反应是: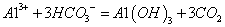
C.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
D.上述过程中与NaOH溶液反应的物质有三种,且反应结束后的溶液显碱性
查看答案和解析>>
科目: 来源: 题型:
根据碘与氢气反应的热化学方程式
①I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
2HI(g)△H=-9.48kJ/mol
②I2(s)+H2(g) 2HI(g)△H=+26.48kJ/mol
2HI(g)△H=+26.48kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com