
科目: 来源: 题型:
通过分析元素周期表的结构和各元素性质的变化趋势,下列关于砹(原子序数为85)及其化合物的叙述中肯定不正确的是( )
A.由KAt的水溶液制备砹的化学方程式为2KAt+Cl2===2KCl+At2
B. AgAt是一种难溶于水的化合物
C.相同条件下HAt比HI稳定
D.At元素位于第六周期
查看答案和解析>>
科目: 来源: 题型:
在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中:K+、Ba2+、H+、Br-
B. 加入Al能放出H2的溶液中:K+、Na+、NO3-、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、K+、Br-
D.能使石蕊试液显红色的溶液中:K+、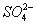 、S2-、
、S2-、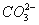
查看答案和解析>>
科目: 来源: 题型:
下表中关于物质分类的正确组合是 ( )
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | CO | CuO | H2SO4 | NH3·H2O | Na2S |
| B | CO2 | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿佛加德罗常数,下列说法正确的是( )
A. 300 mL 2 mol·L-1的蔗糖溶液中所含分子数为0.6NA
B. 在标准状况下,2.8g N2和2.8g CO所含电子数不相等
C. 0.2 mol H2O2完全分解转移的电子数为0.2NA
D.在常温常压下,2.24L SO2与O2的混合气体中所含氧原子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是( )
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D. NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
查看答案和解析>>
科目: 来源: 题型:
准确配制一定物质的量浓度的NaOH溶液,下面实验操作中不正确的是( )
A. 用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中
B. 将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中
C. 定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切
D. 将称好的NaOH固体放入烧杯中,加入适量水溶解
查看答案和解析>>
科目: 来源: 题型:
化学已经渗透到人类生活的各个方面,下列说法正确的是( )
A. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 氮的固定只有在高温、高压、催化剂的条件下才能实现
C. 服用铬含量超标的药用胶囊会对人体健康不会造成危害
D. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
查看答案和解析>>
科目: 来源: 题型:
(1)钠镁铝三种元素中第一电离能最大的是 (填元素名称)。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
A. NH4Cl晶体 B. Na3AlF6晶体 C. Na2CO3•10H2O晶体
D. CuSO4溶液 E. CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
根据上表数据推算并写出氨气分解为氮气和氢气的热化学方程式:
。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(7)石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为 ;C60的晶体结构类似于干冰,则每个C60晶胞的质量为 (用含NA的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
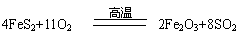
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。
其反应的化学方程式为:
 | |||||||
 | |||||||
| |||||||
| |||||||
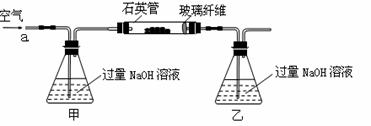
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
 |
(1)鼓入空气的作用是__________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是_______(用化学方程式表示)。
H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为__________(列出表达式即可)。
【实验二】:测定铁元素的含量
 |
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com