
科目: 来源: 题型:
用所学的化学知识,回答下列问题:
(1)从海水中提取镁的主要步骤有:①浓缩结晶(在HCl气流中) ②加熟石灰 ③加盐酸
④过滤 ⑤熔融电解,请按照顺序写出正确的操作步骤(填序号):____________________
(2) 化学方程式(未配平)As2S3 +H2O+NO3- = AsO43-+NO+ _______+SO42-,回答下面的问题:
a. 反应后溶液显_____性(写酸、碱、中);
b. 每1mol水参加反应,该反应转移电子的数目为_______
(3) 向过量的FeSO4溶液中加入几滴NaClO溶液,并且加入少量稀硫酸,发现溶液变成黄色。某同学认为该反应的还原产物有两种可能性,可能是Cl2或Cl-;而实验证明还原产物只存在Cl- 。回答下列问题:
a. 还原产物中不存在氯气的原因是__________________________ (用化学用语表示)
b. 写出上述过程的离子方程式____________________________________
c. 为了检验上述反应是否生成了Cl-,请从下面选择合适的序号,并按照先后顺序排列,进行实验操作。则正确的操作顺序为__________________
A. 取一支试管,加入上述反应后的溶液的少许;B. 加入过量的氯化钡溶液;C. 加入过量的硝酸钡溶液; D. 加入硝酸酸化的硝酸银溶液,观察到白色沉淀;E. 过滤,取滤液
查看答案和解析>>
科目: 来源: 题型:
实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用酸性KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g的粗样品溶于水,用0.40 mol/L的酸性 KMnO4溶液滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
① 滴定终点时的现象是________________________________________________________
② 写出该滴定反应的离子方程式__________________________________________________
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测定结果________(填“偏高”“偏低”或“不变”)
④经计算,产品中Na2S2O3·5H2O的质量分数为 ________
查看答案和解析>>
科目: 来源: 题型:
已知由短周期元素组成的物质 A 、 B 、C 、D ,具有如下反应关系:
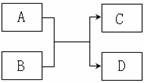 |
(1) 通常若A为黄绿色单质,B为无色液态化合物,且0.1mol/L的C溶液pH=1,则D物质的结构式为_____________
(2) 若B为化合物,且A、C两种无色气体相遇后变为红棕色,则B物质溶于水后显碱性的原因是__________________________________________________(用化学用语说明)
(3)若A为单质,C和D为常见的易燃气体,则该反应的化学方程式是____________________________________________________
(4) 若A为单质,B通常是无色液态化合物,灼烧D产生黄色火焰,则:
①若B分子含有10个电子,A与B反应的离子方程式是______________________________
②若B分子含有18个电子,则A+B→C+D的化学方程式为_____________________________
查看答案和解析>>
科目: 来源: 题型:
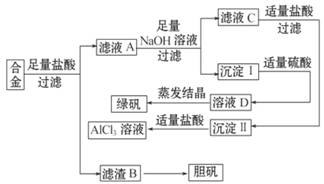 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
(1)小组成员经过检测,发现制得的绿矾不纯,最可能的原因是_________________________;要想由沉淀Ⅰ最终制得纯度较高的绿矾,改进方法是__________________________________
(2)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的离子方程式为_____________________________________
(3)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能制得这三种物质,该方案比前一种方案相对更合理,原因是:__________________________________
查看答案和解析>>
科目: 来源: 题型:
将28克铁粉溶于500mL的某稀硝酸溶液中,二者刚好完全反应,已知还原产物只有NO,且反应后的溶液比反应前增加了16克,则原硝酸浓度是( )mol/L
A. 6.4 B. 4.8 C.3.2 D.2.4
查看答案和解析>>
科目: 来源: 题型:
金属钾的冶炼方法:2KF+CaC2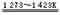 CaF2+2K↑+2C ,下列说法正确的是( )
CaF2+2K↑+2C ,下列说法正确的是( )
A.该反应的氧化剂是KF,氧化产物是K B.该反应能说明C的还原性大于K
C.不能用电解KF溶液来制备金属钾 D. CaC2和CaF2中阴阳离子个数比均2:1
查看答案和解析>>
科目: 来源: 题型:
相同物质的量的下列物质:①金属钠 ②烧碱 ③过氧化钠 ④氧化钠,长期放置在空气中(不考虑潮解和水解),最后质量都会增加,按增加的质量由大到小排列,正确的是( )
A. ①>②>④>③ B. ①>②>③>④ C. ④>①>③>② D. ④>①>②>③
查看答案和解析>>
科目: 来源: 题型:
下列选项中,离子方程式书写正确的是( )
A.向硝酸银溶液中加入足量的氨水:Ag+ +2NH3·H2O = Ag(NH3)2+ + 2H2O
B. 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-= 3Fe3++ 2H2O+NO↑[
C.泡沫灭火器的灭火原理:2Al3+ +3CO32-+3H2O = 2Al(OH)3↓+ 3CO2↑
D.用足量的氨水处理合成氨工业的尾气:SO2+ NH3·H2O = NH4+ + HSO3-
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是( )
A.二氧化硅能与NaOH溶液反应,又能和HF反应,属于两性氧化物
B.工业上精炼Cu,阳极用的电极材料是粗铜
C.Fe3O4既能通过化合反应得到,又能通过置换反应得到
D.周期表中的碱金属元素,从上到下,熔点依次降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com