
科目: 来源: 题型:
下列说法正确的是( )
A.由于钠比铜活泼,故将钠投入到CuCl2溶液中,会生成红色的金属铜
B.将足量的Na、Mg、Al三种金属分别投入到含有等质量HCl的稀盐酸中,生成H2的质量也相同
C.钠投入到稀H2SO4中,钠先与H2SO4反应,钠投入到Fe2(SO4)3溶液中,钠先与H2O反应
D.钠投入到饱和NaCl溶液中,无NaCl析出
查看答案和解析>>
科目: 来源: 题型:
将一小块钠投入到盛有5 mL饱和澄清石灰水的烧杯中,不可能观察到的现象是( )
A.钠熔成小球并在液面上到处游动
B.有气体产物生成
C.溶液中有银白色金属析出
D.溶液变浑浊
查看答案和解析>>
科目: 来源: 题型:
某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠具有下列性质中的( )
①钠密度比水小 ②钠的熔点较低 ③钠与水反应时要放出热量 ④钠与水反应后溶液呈碱性
A.①④ B.①②④
C.①③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
取一小块金属钠放在燃烧匙中加热,下列实验现象描述正确的是( )
①金属钠先熔化 ②在空气中燃烧,产生黄色火焰
③燃烧后得白色固体 ④燃烧后生成淡黄色固体物质
A.①② B.①②③
C.③④ D.①②④
查看答案和解析>>
科目: 来源: 题型:
尼龙是目前世界上产量最大、应用范围最广、性能比较优异的一种合成纤维。以X为原料合成尼龙-66的流程如下:
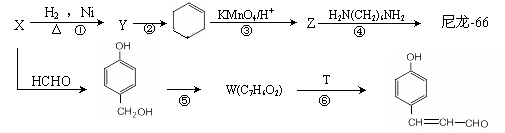
已知部分信息如下:
I.Z的化学式为C6H10O4。
Ⅱ.X和浓溴水反应产生白色沉淀。
Ⅲ.某些醛与醛之间能发生羟醛缩合反应,例如:
|
|

|
|
|

请回答下列问题:
(1)X的化学名称为______________________。W的结构简式为______________________。T的分子式为 ______________________。
(2)反应②的条件为____________________________________________________。
(3)写出反应④的化学方程式______________________________________________。反应⑤的类型为 ______________________。
(4)G是Z少一个碳原子的同系物,M是G的同分异构体。M既能发生银镜反应和水解反应。又能和碳酸氢钠反应产生气体,M的结构共有___________种,其中,在核磁共振氢谱上有3个峰的结构简式为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
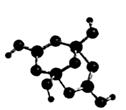 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2 +与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2 +与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
(1)写出Z的基态原子外围电子排布_______________________。
(2)R的某种钠盐晶体,其阴离子Am- (含R、W、氢三种元素)的球棍模型如上图所示:在Am-中,R原子轨道杂化类型有____________;m=____________。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为______________________。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是______________________。
A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似。若晶胞边长为a pm,则晶胞的密度为___________________________g•cm-3。(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90%CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如下:
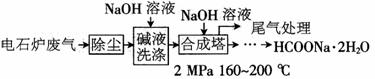
(1)上述工艺用碱液洗涤的目的是__________________________________________,可能发生的反应有_______________________________________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是___________________________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为____________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体.可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为_______________。
查看答案和解析>>
科目: 来源: 题型:
雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)  N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=______________________________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________ (填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q______________ (填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
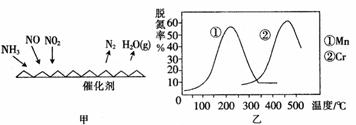
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳,若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为___________________________。
(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下,吸收液中c(Ca2+)一直保持为0.70 mol·L-1,已知Ksp(CaSO3)=1.4×10-7,求吸收后溶液中的SO32-的浓度_______________。(写出计算过程,结果保留2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com