
科目: 来源: 题型:
实验室中有6瓶失去标签的白色固体:纯碱、氢氧化镁、氯化钡、硫酸铝、硫酸氢钠、氯化钾。除蒸馏水、试管和胶头滴管外,无其他任何试剂和仪器。某学生通过以下实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体于6支试管中,分别加入适量蒸馏水,有一支试管中的现象和其他5支明显不同,此试管中的现象是______________________________________________,
据此现象鉴别出的一种物质是__________。
(2)分别将所剩5种溶液依次编号为A、B、C、D、E,然后进行两两混合。观 察到C没有出现任何现象;D分别和A、B、E混合时均产生了白色沉淀;B和E混合时既有白色沉淀产生,又有无色气体放出。据此可推断出:
察到C没有出现任何现象;D分别和A、B、E混合时均产生了白色沉淀;B和E混合时既有白色沉淀产生,又有无色气体放出。据此可推断出:
①A、C、D三种物质的化学式依次是_______________________________________。
②B、E两者中有一种可与A反应,它与足量A反应的离子方程式为________ ____。
____。
③在两两混合时,能最终确定B、E成分的实验现象及结论是_____________________。
(3)上述物质溶于水抑制水的电离,且溶液显酸性的物质的化学式为________,其溶液显酸性的原因是________________。
查看答案和解析>>
科目: 来源: 题型:
物质A~G是中学化学中常见的物质,这些物质有如图所示的转化关系(部分反应物、生成物没有列出)。其中A、B、F含有一种相同的元素,C、D、G含有一种相同的元素,F具有磁性,G为黑色非金属单质。
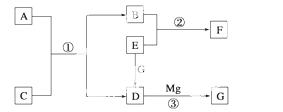
(1)物质A溶解于盐酸,然后加入KSCN溶液,溶液不变色,再滴加几滴氯水, 溶液变为血红色,由此推知A的化学式为__________。
溶液变为血红色,由此推知A的化学式为__________。
(2)反应③的化学方程式是_______________________ _______________________。
_______________________。
(3)写出下列物质的化学式: E__________、F__________。
E__________、F__________。
(4)若C是一种气体,在温度为1 100 ℃的某固定容积的密闭容器中发生反应:A(s)+C(g)B(s)+D(g) ΔH=a kJ·mol-1(a>0),该温度下平衡常数K=0.263。若生成1 mol B,则吸收的热量________(选填“大于”、“等于”或“小于”)a kJ;若加入过量的A,则C的转化率________(选填“升高”、“不变”或“降低”);若容器内压强不再随时间变化,则该反应__________(选填“达到”、“未达到”或“不一定达到”)化学平衡状态;该反应达到化学平衡状态时,若c(C)=0.100 mol·L-1,则c(D)=________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
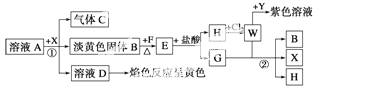
从物质A的水溶液出发,有如图所示的一系列变化(参加反应或反应生成的H2O没有表示出来)。
试完成下列问题:
(1)写出下列物质的化学式:
A________,E________,X________,Y________。
 (2)写出步骤①②发生反应的离子方程式:
(2)写出步骤①②发生反应的离子方程式:
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
⑴ 甲平衡时A的体积分数为 ;
⑵ 若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”);
⑶ 若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)= ;
⑷ 若x=4,则W% 40%(填“大于”、“小于”或“等于”,下同);平衡时乙中的
c(A) 甲中的c(A)。
查看答案和解析>>
科目: 来源: 题型:
研究CO2的利用对促进低碳社会的构建具有重要的意义。
⑴已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为______________。
⑵高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是______________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为 ______________。


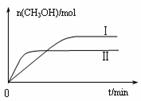
图1 图2 图3
⑶二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=______________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH_______(填“>” “<”或“=”)0。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________。
查看答案和解析>>
科目: 来源: 题型:
过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
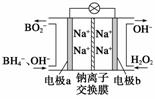 ⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。
⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。
⑵火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:
N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
 H2O2(l)===H2O(l)+
H2O2(l)===H2O(l)+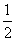 O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___
__________________________________________。
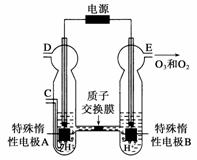
⑶O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”)。
②若C处通入O2,则A极的电极反应式为____________。
③若C处不通入O2,D、E处分别收集到15.68 L和6.72 L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为__________(忽略O3的分解)。
 ⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)
⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间
变化的示意图如右图所示。由图可得出的正确说法是________。
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
科目: 来源: 题型:
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
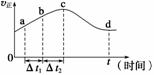
 ⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时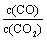 增大的是______(填序号)。
增大的是______(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目: 来源: 题型:
⑴已知4NH3(g)+5O2(g)=4NO(g) +6H2O(l),△H=x kJ/mol。蒸发1mol 液态水需要吸收的能量为44kJ,其它相关数据如下表:
| NH3(g) | O2(g) | NO(g) | H2O(g) | |
| 1mol分子断裂化学键时需要吸收的能量/kJ | a | b | z | d |
则表中z(用x、a、b、d表示)的大小为______________________________________________
⑵已知a g 乙烯气体充分燃烧时生成1molCO2和液态水,放出b k J的热量,则乙烯燃烧热的热化学方程式为________________________________________________。
⑶利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
⑷肼(N2H4)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
500m L KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
①原混合溶液中c(K+)= 4mol·L-1 ②原混合溶液中c(K+)= 2mol·L-1
③电解得到的Cu的物质的量为0.5mol ④电解后溶液中c(H+)=2mol·L-1
⑤向电解后的溶液中加入一定量的CuO可恢复为原溶液
⑥向电解后的溶液中加入一定量的Cu(OH)2可恢复为原溶液
⑦上述电解过程中共转移了4mol电子 ⑧电解后溶液中c(H+)=4mol·L-1
A.②⑥⑦⑧ B.①④⑤⑦ C.②⑤⑦⑧ D.①③④⑥
查看答案和解析>>
科目: 来源: 题型:
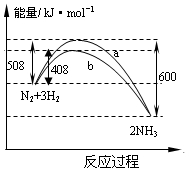
右图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是( )
A.该反应的热化学方程式为
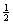 N2(g)+
N2(g)+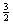 H2(g)
H2(g) NH3(g),△H=-92kJ·mol-1
NH3(g),△H=-92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46 KJ
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com