
科目: 来源: 题型:
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:
2KClO3+H2C2O4+H2SO4  2ClO2↑+K2SO4+2CO2↑+2H2O
2ClO2↑+K2SO4+2CO2↑+2H2O
下列说法不正确的是 ( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2做水处理剂时,利用了其强氧化性
查看答案和解析>>
科目: 来源: 题型:
氮化铝(AlN)广泛应用于电子,陶瓷等工业领域,在一定的条件下,AlN可通过反应
 Al2O3+N2+3C 2 AlN+3CO合成,下列叙述正确的是 ( )
Al2O3+N2+3C 2 AlN+3CO合成,下列叙述正确的是 ( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂;
B.上述反应中,每生成1mol AlN,需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目: 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2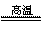 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
查看答案和解析>>
科目: 来源: 题型:
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目: 来源: 题型:
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1200mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②12KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
查看答案和解析>>
科目: 来源: 题型:
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8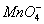 +5Cu2S+44H+====12Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====12Cu2++5SO2+8Mn2++22H2O
6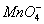 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

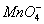 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
(4)混合物中Cu2S的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g ③(a+b)mol ④(Vc-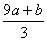 )mol
)mol
A.①④ B.②③
C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-=== 2Fe2+。据此,回答下列问题:
⑴将反应Zn+2H+ === Zn2++H2↑拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑵将反应3NO2+H2O == 2H++2NO3—+NO拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑶已知某反应的两个“半反应式”为:CH4+12 OH--8e-===CO32-+7H2O,O2+2H2O+4e-=== 4OH—,则氧化还原反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com