
科目: 来源:不详 题型:问答题
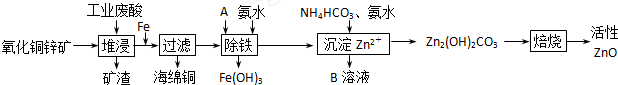
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目: 来源:不详 题型:问答题

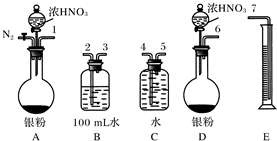
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.乙烯与氯气加成(1,2-二氯乙烷) |
| B.乙烯与水加成(乙醇) |
| C.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) |
| D.氯气与苯用氯化铁做催化剂反应(氯苯) |
查看答案和解析>>
科目: 来源:宜宾模拟 题型:单选题
| A.实验内容:向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热 实验目的:检验混合物中是否含有甲醛 |
| B.实验内容:向米汤中加入含碘的食盐,观察是否有颜色的变化 实验目的:检验含碘食盐中是否含碘酸钾 |
| C.实验内容:向红砖粉末中加入盐酸,充分反应后,取上层清液于试管中,滴加硫氰化钾溶液,观察溶液颜色的变化 实验目的:检验红砖中是否含有+3价铁 |
| D.实验内容:向淀粉溶液中加入稀硫酸,加热后,再做银镜反应实验 实验目的:检验淀粉是否水解 |
查看答案和解析>>
科目: 来源:宣城二模 题型:问答题
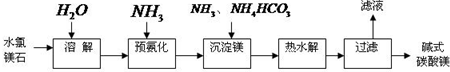
查看答案和解析>>
科目: 来源:不详 题型:填空题
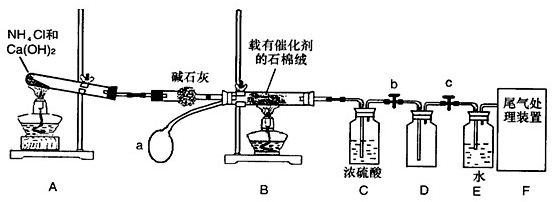
查看答案和解析>>
科目: 来源:不详 题型:填空题
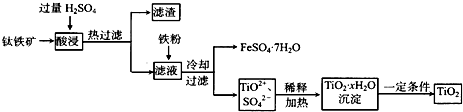
| ||
查看答案和解析>>
科目: 来源:宜宾模拟 题型:问答题
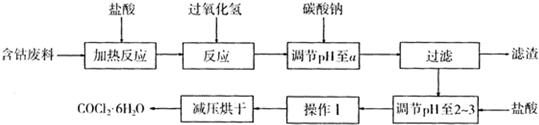
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
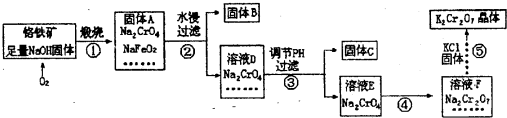
查看答案和解析>>
科目: 来源:嘉兴模拟 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com