
科目: 来源: 题型:
下列叙述正确的是
A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深
D.牺牲阳极的阴极保护法和外加直流电源的阴极保护法都是应用电解原理
查看答案和解析>>
科目: 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A. 电解饱和MgCl2溶液:2Cl-+2H2O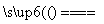 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向Na2SO3溶液中滴加足量NaClO溶液:SO + ClO-= SO
+ ClO-= SO + Cl-
+ Cl-
C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D.向Ca(OH)2溶液中加少量NaHCO3溶液:
2 HCO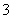 +Ca2++2OH-=CaCO3↓+ CO
+Ca2++2OH-=CaCO3↓+ CO +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.将0.1 mol CO2通入足量NaOH溶液,则溶液中阴离子数目为0.1 NA
B.标准状况下,将11.2 L的Cl2通入足量的NaOH溶液中,转移的电子数为NA
C.0.1 mol N2与足量H2反应,转移的电子数为0.6 NA
D.标准状况下,1.12 L HCHO中C原子的数目为0.05 NA
查看答案和解析>>
科目: 来源: 题型:
| ② | ③ | ④ | ||
| 甲 | C | N2 | S | Fe |
| 丙 | CO2 | NO2 | SO3 | Fe(NO3)3 |
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素。下列各组物质可按下图转化的是
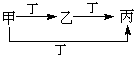
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.遇苯酚变紫色的溶液:Na+、Mg2+、SO 、Cl-
、Cl-
B.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO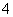
C.使甲基橙变红色的溶液:NH 、Cu2+、ClO-、Cl-
、Cu2+、ClO-、Cl-
D. 0.1mol·L-1 NaHCO3溶液:K+、AlO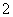 、Cl-、NO
、Cl-、NO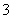
查看答案和解析>>
科目: 来源: 题型:
下列表述正确的是
A.甲烷分子的球棍模型:
B.Cl的原子结构示意图: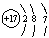
C.质子数是82,中子数是122的铅原子: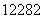 Pb
Pb
D.HCO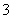 水解的离子方程式:HCO
水解的离子方程式:HCO +H2O
+H2O H2CO3+H3O+
H2CO3+H3O+
查看答案和解析>>
科目: 来源: 题型:
化学与生产生活、环境保护、资源利用、能源开发等密切相关。下列说法错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
查看答案和解析>>
科目: 来源: 题型:
空气质量越来越受到人们的关注,下表是我国部分城市空气质量周报:
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 |
| 太原 | 98 | SO2 | Ⅱ |
| 青岛 | 47 | Ⅰ | |
| 兰州 | 103 | TSP | Ⅲ |
| 广州 | 90 | NOx | Ⅱ |
(注:TSP——总悬浮颗粒物;NOx——氮氧化物)
(1)由上表可知,从理论上分析最容易出现酸雨的城市是________。
(2)悬浮颗粒物不易沉降,它与空气中的SO2、O2接触时,SO2会部分转化为SO3,悬浮颗粒物所起的作用是________(填序号)。
A.氧化剂 B.还原剂 C.催化剂 D.吸附剂
(3)氮的氧化物也是大气污染物之一。目前,治理NO的方法是在一定条件下用氨把一氧化氮还原为氮气和水。科学家又设想,在相同条件下可采用价格比NH3更便宜的天然气来处理NO,达到同样效果,写出该反应的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
对某次采集的酸雨样品,每隔一段时间测定一次pH,得到数据如下:
| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
回答:(1)放置时,雨水样品pH变化的主要原因。(2)pH变化的化学方程式。
查看答案和解析>>
科目: 来源: 题型:
实验室制取SO2的反应原理为:
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
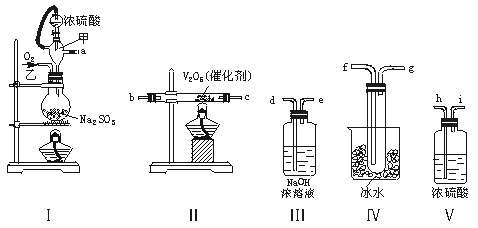
(1)这些装置的连接顺序(按气体左右的方向)是_____________→_____________→_____________→_____________→
_____________→_____________→_____________→_____________(填各接口的编号)。
(2)实验时甲仪器的作用与原理是_____________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是_____________。
(4)Ⅳ处观察到的现象是_____________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会_____________(填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com