
科目: 来源: 题型:
据报道,某外资企业发生了管道内氯气瞬间泄漏的事故。如果你是处理事故的现场总指挥,你不能做出的举措是( )
A.告诉人们该气体有毒
B.提醒人们跑向地势高的地方
C.提醒人们可以用浸润了肥皂水的毛巾捂住嘴
D.提醒人们可以用浸润了食醋的毛巾捂住嘴
查看答案和解析>>
科目: 来源: 题型:
硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
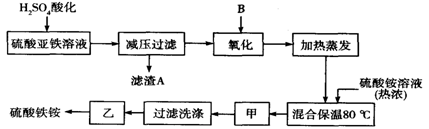
请回答下列问题:
(1)下列物质中最适合的氧化剂B是 ;
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
反应的离子方程式 。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为 (写名称),能否用酸性的KMnO4溶液? 理由是: 。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH4+的方法是 。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________
查看答案和解析>>
科目: 来源: 题型:
中学化学中常见的几种物质存在下图所示的转化关系。其中, A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)
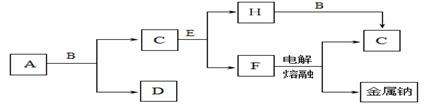
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)固体E中含有化学键的类型是 ,C与E反应的离子方程式为 。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为
。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。
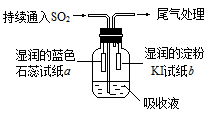
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是 (写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是 。
查看答案和解析>>
科目: 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。 现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)  2Al2O3(s)+3TiC(s)
2Al2O3(s)+3TiC(s)
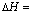 -1176 kJ·mol-1,反应过程中,每转移1 mol电子放出的热量为________。
-1176 kJ·mol-1,反应过程中,每转移1 mol电子放出的热量为________。
(3)硅与铝同周期,地壳里硅铝的含量是硅________铝(填>,<或=); Na2CaSi6O14是硅酸盐玻璃的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
|
 3Ba↑+BaO·Al2O3, 用化学平衡移动原理解释上述方法可制取金属Ba的原因是_______________________________.
3Ba↑+BaO·Al2O3, 用化学平衡移动原理解释上述方法可制取金属Ba的原因是_______________________________. 查看答案和解析>>
科目: 来源: 题型:
Q、W、X、Y、Z为五种原子序数依次增大的短周期元素。已知:
①Q原子的核外电子数等于电子层数,且与W组成的一种化合物是沼气的主要成分;
②元素X的最高价氧化物的水化物和其气态氢化物能够反应,生成离子化合物甲;
③W与Y组成的化合物乙,是机动车排出的大气污染物之一,也是造成“雾霾”天气的有害物质之一;
④Y与Z能形成电子总数为30和38的两种离子化合物,分别为丙和丁
(1)W在周期表中的位置是_______________;
丁的电子式是 ____ _______。
(2)WY2与Z2Y2反应的化学方程式是__________________。
(3)甲在水溶液中的水解方程式为_______________
(4)写出一种实验室制取XQ3的方法____________(用化学方程式表示)
(5)标准状况下22.4L X的气态氢化物,与0.5L 1mol/L的X最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是__________(用化学式表示)。
查看答案和解析>>
科目: 来源: 题型:
某无色溶液中可能含有Mg2+、NH4+、K+、Al3+、SO42-、CO32-、Cl-等离子。现进行如下实验:①取10mL该溶液于试管中,滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到6.99g白色沉淀;②另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解,并且随NaOH溶液的加入,沉淀和气体物质的量变化如图所示。下列说法不符合事实的是
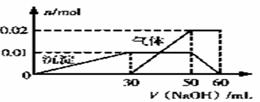
A. 根据信息分析该溶液中焰色反应呈紫色的离子的物质的量浓度为1 mol·L-1
B. 根据图中数据计算实验中使用的NaOH溶液的浓度为1 mol·L-1
C. 该溶液中NH4+、Al3+、SO42-三种离子的物质的量之比为2:1:3
D. 另取一定量该溶液滴加一定量Ba(OH)2溶液,不可能Al3+和SO42-同时完全沉淀
查看答案和解析>>
科目: 来源: 题型:
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确的是
A.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol
B.参加反应的金属的总质量3.6 g < m < 9.6 g
C.当金属全部溶解时收集到NO气体的体积一定为2.24 L
D.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质。已知:甲 + 乙 =丁 +辛,甲 + 丙 = 戊 + 辛;常温下0.1 mol/L 丁溶液的pH为13,则下列说法正确的是
A.元素B、C、D的原子半径由大到小的顺序为:r(D) > r(C) > r(B)
B.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合 物中均存在共价键
C.1.0 L 0. 1 mol/L戊溶液中含阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204 × 1024个电子
查看答案和解析>>
科目: 来源: 题型:
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3∶2∶1 B.2∶4∶1 C.2∶3∶1 D.4∶2∶1
查看答案和解析>>
科目: 来源: 题型:
关于下列各图的说法中,正确的是
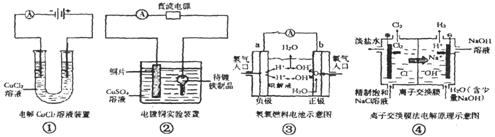
A.①中与电源负极相连的电极附近能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应该与电源的正极相连接
C.③中的b极是电子流出的极,发生氧化反应
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com