
科目: 来源: 题型:
Ⅰ.某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物单质X。
(1)写出反应的化学方程式:__________________________________________________。
(2)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
Ⅱ.常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH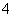 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。请回答:
(3)所含阴离子相同的两种盐的化学式是________________________________。
(4)A的化学式为________,D溶液显碱性的原因是(用离子方程式表示):
______________________________________________________。
(5)若要检验B中所含的阳离子,正确的实验方法是
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2 mol·L-1 NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出。
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵。
③很多合金是金属互化物,有确定的化学组成。
④固体L与某种宝石的主要成分相同。
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式。
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | 不含有Li、Na等活泼金属 |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _____________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论_________(选填“正确”或“错误”)。判断理由为 。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
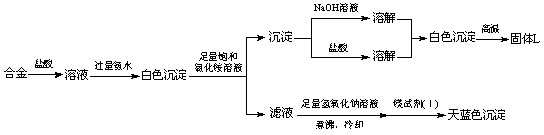 由丙的实验记录可知,该焰火原料是由__________(填元素名称)两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是_____________________。
由丙的实验记录可知,该焰火原料是由__________(填元素名称)两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是_____________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。

问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
a.m、n b.m、y c.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
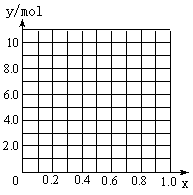
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________。
查看答案和解析>>
科目: 来源: 题型:
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
① 此温度下,该反应的平衡常数K=________(注明单位)。
② 保持温度不变,改变CH4和CO2的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内气体平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗2a mol H2
d.混合气中n(CH4)∶n(CO2)∶n(CO)∶n(H2) =1∶1∶4∶4
③ 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=_______________ kJ·mol-1
2CO(g)+2H2(g)的△H=_______________ kJ·mol-1
 (2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
CO2+CH4 CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是_________。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
 c. 可在ⅠA、ⅡA族元素的氧化物中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式___________ ____________________________________。
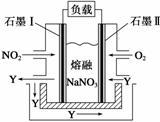
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,有关电极反应可表示为______________________。
查看答案和解析>>
科目: 来源: 题型:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
| 容器 | 甲 | 乙 |
|
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
下列说法正确的是
A. T2时该反应的平衡常数K=0.8
B. 由图可知:T1<T2,且该反应为吸热反应
C. 前10min乙、丙两容器中v(A)乙>v(A)丙
D. C的质量m:m甲=m乙<2m丙
查看答案和解析>>
科目: 来源: 题型:
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物NO2能溶于浓硝酸 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目: 来源: 题型:
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
A、若平衡时,甲、乙两容器中A的物质的量相等,则x=4
B、平衡时,甲、乙两容器中A、B的物质的量之比不相等
C、平衡时甲中A的体积分数为40%
D、若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A、难溶电解质的Ksp越小,溶解度就一定越小
B、一般认为沉淀离子浓度小于1.0×10-5 mol/L时,沉淀就达完全
C、用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4)
D、向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小
查看答案和解析>>
科目: 来源: 题型:
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
A、①②③④⑤ B、②③④⑤ C、①③④ D、①②③④
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是
A.三氯化铝溶液中加入过量氨水:Al3++3OH-==Al(OH)3↓
B.向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I-+2Fe2++5Cl2==10Cl-+4I2+2Fe3+
C.K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO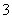 +6HCl
+6HCl 37Cl-+3Cl2↑+3H2O
37Cl-+3Cl2↑+3H2O
D.将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO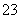 ==CO2↑+H2O
==CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
A.盐桥中的K+移向乙烧杯
B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
C.在外电路中,电子从石墨电极流向银电极
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com