
科目: 来源: 题型:
某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl--离子的物质的量约等于( )
A.0.37mol B.0.63mol C.0.74mol D.l.5mol
查看答案和解析>>
科目: 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
 ② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:





 Fe3+ + SO32- + == F e2+ + +
Fe3+ + SO32- + == F e2+ + +
乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| III | 向1 mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是______(填字母)。
a.K3 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目: 来源: 题型:
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
|
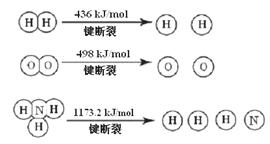
(1) 计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) = 2NO (g) ΔH = +180.8 kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙两种方式分别投料(物质的量如下表)所示,发生反应:3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
 ①3H2 (g) + N2 (g)
①3H2 (g) + N2 (g)  2NH3 (g)的平衡常数表达式
2NH3 (g)的平衡常数表达式
②判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是 。
(2)反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
(3)x、y对应的数值范围分别是 、 。
(4)下列关于NaClO调pH的说法正确的是 。
a. 加入NaClO可使溶液的pH降低
b. NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,
HClO,
ClO-消耗H+,从而达到调节pH的目的
c .NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,
HClO+OH-,
OH-消耗H+ ,从而达到调节pH的目的
(5)用NaClO调pH,写出氯气制取漂白液的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
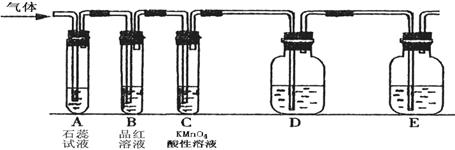 |
(1)从物质分类的角度,SO2属于 (填“酸性”或“碱性”)氧化物。写出硫酸型酸雨形成的反应方程式: 。
① 图中D装置可用来验证SO2具有该性质,其中所加入的试剂是 。
② 当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是 。(2)从元素化合价的角度分析,SO2的性质。
①当向该装置通入SO2 一段时间后,可观察C中溶液褪色,MnO4-转化为Mn2+,说明SO2具有 性,反应的离子方程式为 。
②如验证SO2还具有另一方面的性质,可选择的药品是 。
A.过氧化氢 B. 浓硫酸 C.氯水 D.硫化钠溶液
查看答案和解析>>
科目: 来源: 题型:
X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
请用化学用语回答下列问题:
(1)X在元素周期表中的位置是_______。
(2)元素W的离子结构示意图为_________。
(3)元素R的最高价氧化物的电子式为_________。
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为_________, _______________ 。
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是 。(用离子方程式表示)
(6)W的氢氧化物是重要的基本化工原料。写出工业上制取该氢氧化物的离子反应方程式_______________ 。
查看答案和解析>>
科目: 来源: 题型:
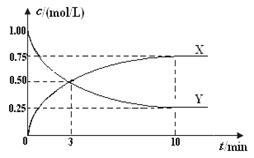
将CO2转化为甲醇的原理为 CO2(g)+3H2(g) 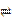 CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化
B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min)
C.平衡时H2 的转化率为75%
D.500 ℃时该反应的平衡常数K=3
查看答案和解析>>
科目: 来源: 题型:
已知:H2(g) + F2(g) = 2HF(g) ΔH=? 270 kJ/mol,下列说法正确的是
A.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用右图来表示
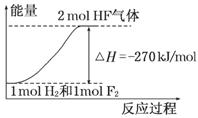
查看答案和解析>>
科目: 来源: 题型:
下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是
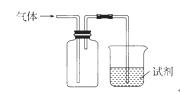
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A. | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B. | C2H4 | 溴水 | 溶液褪色 | 乙烯能与溴发生加成反应 |
| C. | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有还原性 |
| D. | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
查看答案和解析>>
科目: 来源: 题型:
下列实验的现象及结论不正确的是
A.过氧化钠放置在空气中,最终转变为白色粉末Na2CO3
B.SO2通入BaCl2溶液中产生白色沉淀BaSO3
C.打磨过的铝箔和未打磨的铝箔分别在空气中灼烧,两种铝箔均熔化但不滴落,说明氧
化铝熔点比铝高
D.分别向等物质的量浓度的Na2CO3和NaHCO3溶液中滴加酚酞,溶液都变红,Na2CO3 溶液红色较深,说明Na2CO3水解程度大于NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com