
科目: 来源: 题型:
下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目: 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q弱
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目: 来源: 题型:
金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生命金属”之称。下列有关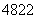 Ti和
Ti和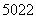 Ti的说法中正确的是( )
Ti的说法中正确的是( )
A.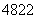 Ti和
Ti和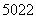 Ti中均含有22个中子
Ti中均含有22个中子
B.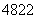 Ti和
Ti和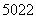 Ti核外均有4个电子层
Ti核外均有4个电子层
C.分别由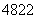 Ti和
Ti和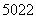 Ti组成的金属钛单质互称为同分异构体
Ti组成的金属钛单质互称为同分异构体
D.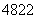 Ti和
Ti和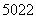 Ti的性质完全相同
Ti的性质完全相同
查看答案和解析>>
科目: 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4 + 6Na2O2===2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
________________________________________________________________________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO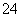 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO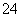 转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的________倍。
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO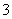 、CO
、CO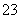 、SO
、SO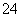 离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如下图所示:
离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如下图所示:
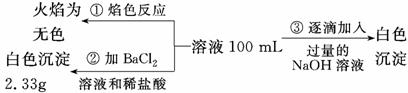
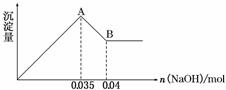
请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒 、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_________________________________________。
、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_________________________________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为____________________。
③试确定NO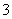 是否存在?________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO
是否存在?________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO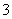 )=________(若不存在,此问不必作答)。
)=________(若不存在,此问不必作答)。
查看答案和解析>>
科目: 来源: 题型:
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH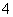 、Cl-、CO
、Cl-、CO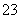 、SO
、SO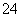 ,现分别取100 mL的两等份溶液进行如下实验:
,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
(1)一定不存在的离子是________(填离子符号,下同)。
(2)由①可知存在离子为________,浓度________。由②可知存在离子为________,浓度________。
由③可知存在离子为________,浓度________。
(3)K+是否存在?________(填“是”或“否”),理由是___________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列说法正确的是( )
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:I2>Cu2+>SO2
查看答案和解析>>
科目: 来源: 题型:
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O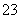 +O2+aOH-===Y+S4O
+O2+aOH-===Y+S4O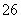 +2H2O,下列说法中,不正确的是( )
+2H2O,下列说法中,不正确的是( )
A.a=4
B.Y的化学式为Fe2O3 [来源:学科网]
C.S2O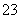 是还原剂
是还原剂
D.每有1 mol O2参加反应,转移电子的总物质的量为4 mol
查看答案和解析>>
科目: 来源: 题型:
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,S2O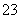 与Cl2反应的产物之一为SO
与Cl2反应的产物之一为SO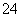 。下列说法中,错误的是( )
。下列说法中,错误的是( )
A.该反应中的氧化剂是S2O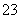
B.SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂
C.上述反应中,每生成1 mol SO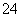 ,
, 可脱去2 mol Cl2
可脱去2 mol Cl2
D.根据该反应可判断还原性:S2O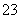 >Cl-
>Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com