
科目: 来源: 题型:
人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3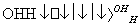 HCO
HCO ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO )∶c(H2CO3)变化关系如下表:
)∶c(H2CO3)变化关系如下表:
| c(HCO | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO 的水解程度大于电离程度
的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)>c(HCO )
)
D.pH=7.40的血液中,HCO 的水解程度一定大于H2CO3的电离程度
的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
科目: 来源: 题型:
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是( )
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.CuS的溶解度比MnS的溶解度小
C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应平衡常数表达式:K=
查看答案和解析>>
科目: 来源: 题型:
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH )
)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH )>c(SO
)>c(SO )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目: 来源: 题型:
下列关于常温下电解质溶液的叙述中,正确的是( )
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO +OH-===CO
+OH-===CO +H2O
+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH )前者大于后者
)前者大于后者
D.25℃时,pH=8的0.1 mol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
| 序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1 B.4
C.5 D.6
查看答案和解析>>
科目: 来源: 题型:
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO 、SO
、SO 、Na+
、Na+
B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的水溶液中:NH 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO 、SCN-
、SCN-
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14
B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液
C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱。
查看答案和解析>>
科目: 来源: 题型:
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+,对于该平衡下列叙述正确的是( )
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.25℃时,三种酸的电离常数为:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:________(填编号)
(2)常温下0.1 mol/L的CH3COOH电离度约为1%,其pH=________,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000 mL,稀释过程pH变化如图;则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”)。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH 3COO-)-c(Na+)=________(填准确数值)。
3COO-)-c(Na+)=________(填准确数值)。
Ⅱ.锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图。

请回答:
(5)步骤③中调节溶液pH至8~10,宜选用的试剂为________。
A.稀硫酸 B.氢氧化锶粉末
C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是________(填化学式)。
(6)若滤液中Ba2+ 浓度为1×10-5mol·L-1,依据下表数据可以推算滤液中Sr2+物质的量浓度为________。
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1 × 10-10 | 3.2 × 10-4 | 2.6× 10-39 | 4.87× 10-17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com