
科目: 来源: 题型:
下列各种说法中,正确的是( )
A.电离时生成的阳离子全部是氢离子的化合物一定是酸
B.所有的盐电离时只能生成酸根阴离子和金属阳离子。
C.氧化物是指含有氧元素的化合物,如NaOH、H2SO4等。
D.氨气溶于水溶液显碱性,所以氨气属于碱
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
①1mol氧元素 ②0.25mol氯离子 ③0. 5mol 氢分子
④氢氧化钠的摩尔质量是40g/mol
⑤0.1mol水分子中含有NA个质子和NA个电子
⑥0.25mol 氨气在标准状况下体积约为5.6升。
A. 全部正确 B.②③④⑤⑥ C.①②③④⑥ D.①③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
下列对于“摩尔”的说法和理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
D.摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目: 来源: 题型:
按照物质的树状分类法和交叉分类法,对于H2SO4的分类正确的是( )
①酸 ②氧化物 ③氢化物 ④强酸 ⑤含氧酸
⑥难挥发性酸 ⑦一元酸 ⑧化合物 ⑨混合物
A.①④⑤⑥⑧ B.①②④⑤⑥⑦⑧ C.①③④⑤⑥⑨ D.①④⑤⑥⑦⑨
查看答案和解析>>
科目: 来源: 题型:
氯气是一种重要的化工原料。工业上常用反应3Cl2+8NH3===N2+6NH4Cl检验氯气管道是否漏气。根据材料中的反应回答下列问题:
(1)氧化剂是________,还原剂是________。
(2)氧化剂与被氧化的还原剂分子个数比为________。
(3)当有68 g NH3参加反应时,被氧化的物质为______g,生成的还原产物为________g。
查看答案和解析>>
科目: 来源: 题型:
实验室中迅速制备少量氯气可利用如下反应:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
此反应在常温下就可以迅速进行,而且对盐酸浓度要求不高。
(1)已知高锰酸钾和氯化锰都属于可溶性盐,请把上述化学方程式改写为离子方程式:________________________________________________________________________。
(2)该反应中,氧化剂是________,还原剂是________。当有1 mol氧化剂参加反应时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积约为________。
(3)HCl在此反应过程中表现出的化学性质有________。
A.酸性 B.还原性
C.氧化性 D.挥发性
查看答案和解析>>
科目: 来源: 题型:
已知有如下反应:①2Fe3++2I-===2Fe2++I2;②2Fe2++Cl2===2Fe3++2Cl-;③2MnO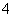 +10Cl-+16H+===2Mn2++5Cl2↑+8H2O。
+10Cl-+16H+===2Mn2++5Cl2↑+8H2O。
(1)判断上述三个反应中,氧化性最强的分子或离子是________。
(2)若某溶液中有Cl-和I-共存时,为氧化I-而使Cl-不被氧化,应选用上述反应中的________离子作为氧化剂。
查看答案和解析>>
科目: 来源: 题型:
在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是________,实例:________。
(2)只能做还原剂的是________,实例:________。
(3)H2O作为氧化剂的反应实例:________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO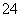 +4H+
+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目: 来源: 题型:
下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)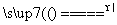 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl===2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(气)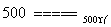 2H2O+2Cl2
2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
A.O2>MnO2>KMnO4 B.KMnO4>MnO2>O2
C.MnO2>KMnO4>O2 D.O2>KMnO4>MnO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com