
科目: 来源: 题型:
下列关于皂化反应的说法中错误的是
( )
A.油脂经皂化反应后,生成高级脂肪酸钠、甘油和水的混合液
B.加入食盐可以使肥皂析出,这一过程叫盐析
C.加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠
D.发生盐析后的混合物可以通过过滤的方法分离得到高级脂肪酸钠
查看答案和解析>>
科目: 来源: 题型:
关于油脂的说法中,不正确的是
( )
A.所有的油脂都能发生皂化反应
B.为了便于油脂的运输,工业上常常把液态油进行氢化
C.油脂都比水轻,浮在水面上
D.纯净的花生油不饱和度高,具有固定的熔、沸点
查看答案和解析>>
科目: 来源: 题型:
下列关于油脂的结构 的说法正确的是
的说法正确的是
( )
A.油脂是高级脂肪酸与甘油生成的酯
B.若R1、R2、R3都是饱和烃基,称为简单甘油酯
C.若R1、R2、R3都是不饱和烃基,称为混合甘油酯
D.某油脂分子中,所含烃基有三种,但每一个油脂分子中所含这三种烃基都相同,而且排列结构也相同,则该油脂为混合物
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++SO
2CuCl↓+4H++SO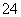
2CuCl2+SnCl2===2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
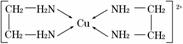
请回答下列问题:
(1)基态Cu原子的核外电子排布式为____________;H、N、O三种元素的电负性由大到小的顺序是_________________________________________________________。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________________________________________________________________________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是________________________________。
(4)②中所形成的配离子中含有的化学键类型有________(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
Ⅱ.固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答:
(5)干冰中一个分子周围有________个紧邻分子。
(6)堆积方式与干冰晶胞类型相同的金属有________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为________。
查看答案和解析>>
科目: 来源: 题型:
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:___________________________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_____________________________________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是_________________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是____________
______________________________________________________ ________(写化学式)。
________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
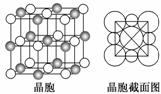
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为____________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则 LaNin中n=________(填数值);氢在合金中的密度为________。
LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目: 来源: 题型:
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满。
根据以上信息回答下列问题:
(1)写出D原子核外电子排布式:____________________________________________。
(2)A、B、C、D的第一电离能由小到大的顺序为________________________________
(用元 素符号表示)。
素符号表示)。
(3)B的氯化物的熔点比D的氯化物的熔点________(填“高”或“低”);理由是______
___________________________________________________________。
 (4)E的最高价氧化物分子的空间构型是________,是________(填“极性”或“非极性”)分子。
(4)E的最高价氧化物分子的空间构型是________,是________(填“极性”或“非极性”)分子。
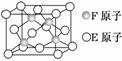
(5)E、F形成的某种化合物有如图所示的晶体结构:该化合物化学式为________;E原子配位数为________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
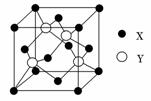
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________。
(4)Y与Z可形成YZ 。
。
①YZ 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
②写出一种与YZ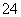 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
查看答案和解析>>
科目: 来源: 题型:
短周期元素在元素中占有重要地位。X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如 下变化:
下变化:


一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是____________周期________族。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在________。
(3)在C分子中,Y原子的杂化方式为________,与Y原子同主族在第四周期的元素原子基态电子排布式是____________________________________________________________。
(4)NaCl的晶体结构如图所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构。则该X的氧化物的化学式为___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com