
科目: 来源: 题型:
已知:H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1。对于下列反应:
①HCl(aq)+NH3·H2O(aq)====NH4Cl(aq)+H2O(l) ΔH=-a kJ·mol-1
②HNO3(aq)+KOH(aq)====KNO3(aq)+H2O(l) ΔH=-b kJ·mol-1
则a、b的大小关系为( )
A.a>b B.b>a
C.a=b D.无法比较
查看答案和解析>>
科目: 来源: 题型:
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ 的能量
的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由氢原子和氯原子形成1 mol 氯化氢分子时释放431 kJ的能量
下列叙述正 确的是( )
确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g)====
2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=183 kJ·mol -1
-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。
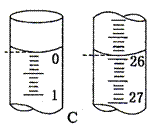
查看答案和解析>>
科目: 来源: 题型:
下图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其他用途:

(1)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,用 于观察气泡产生的情况,以便调节供氧速率, 此时氧气应从 (填标号,下同)管口导入。
(2)实验室用MnO2与浓HCl反应制Cl2的实验中,在将生成的Cl2通入NaOH溶液之前,先将Cl2从该装置 管口导入,此时,该装置所起的作用是防止NaOH溶液倒流入反应器。
(3) 当用此装置收集NO时,应采取的主要操作步骤是:
① ;
② 。
查看答案和解析>>
科目: 来源: 题型:
以石油裂解产物丙烯为原料合成一些新物质的路线如下。
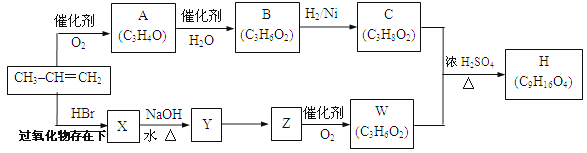
其中A、B、C、X、Y、Z、W、H均为链状化合物,A、Z均能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A中所含官能团的名称为 ,B的结构简式为 。
(2)填反应类型:A→B ,C+W→H 。
(3)写出X→Y反应的化学方程式为:
。
(4)写出A与银氨溶液反应的化学方程式为:
。
(5)写出C+W→H的化学方程式为:
。
(6)符合下列条件分子式为C4H10O2的同分异构体有 种,并写出其中核磁共振氢谱有3个吸收峰且吸收峰面积比为2∶2∶1的结构简式 。
①与C互为同系物,②若分子中有两个羟基不能连在同一个碳原子上。
查看答案和解析>>
科目: 来源: 题型:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
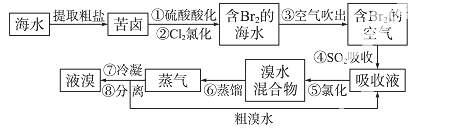
(1)溴在周期表中位于第 _周期第 _族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 _。
(3)步骤④利用了SO2的还原性,反应的离子方程式为 _。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因 _。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 _。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是 _。
查看答案和解析>>
科目: 来源: 题型:
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO +4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
+4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
________________________________________________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
书写离子方程式(8分)
(1) 铜和足量浓硝酸反应的离子方程式为
(2)二氧化锰与足量浓盐酸反应的离子方程式为:
(3)向碳酸氢钾溶液中滴入少量澄清石灰水反应的离子方程式为:
(4)向明矾溶液中加入过量的氢氧化钡溶液反应的离子方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com