
科目: 来源: 题型:
下列有关材料的说法不正确的是( )
A.传统的无机非金属材料虽然有不少优点,但质脆,经不起热冲击
B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差
C.高温结构材料具有能经受高温,不怕氧化,耐酸碱腐蚀,硬度大,耐磨损,密度小的优点
D.新型无机非金属材料特征之一是具有电学特性
查看答案和解析>>
科目: 来源: 题型:
下列说法中,正确的是( )
A.制造水泥和普通玻璃的原料中都含有石灰石
B.普通玻璃是电的绝缘体,这种透明的固体物质熔点很低
C.石英玻璃能经受温度剧变且能抵抗酸碱的腐蚀
D.硅酸盐可用氧化物形式表示其组成,这表明硅酸盐是由氧化物组成的
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.二氧化硅是酸性氧化物,它可以跟碱反应,但不能与任何酸反应
B.根据反应SiO2+CaCO3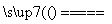 CaSiO3+CO2↑,可推知硅酸的酸性比碳酸的酸性强
CaSiO3+CO2↑,可推知硅酸的酸性比碳酸的酸性强
C.碳酸与硅酸的酸性比较,硅酸酸性弱,且硅酸不溶于水
D.CO2与SiO2均可溶于水生成对应的酸
查看答案和解析>>
科目: 来源: 题型:
下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③
C.①④ D.③④
查看答案和解析>>
科目: 来源: 题型:
下列有关说法中,正确的是( )
A.硅单质既不能与酸反应又不能与碱反应
B.硅在自然界中以化合态存在
C.硅与NaOH溶液的反应中,硅做氧化剂
D.硅元素在地壳中的含量居第一位
查看答案和解析>>
科目: 来源: 题型:
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①检测Fe3+是否除尽的方法是________________________________________。
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因____________________。
③检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测_______(填离子符号)。
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
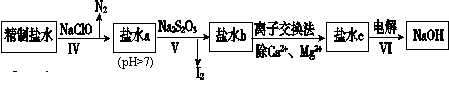

①过程Ⅳ除去的离子是________________。
②过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:___________。
查看答案和解析>>
科目: 来源: 题型:
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加入石英,再通入空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSiO3+4SO2,该反应的氧化剂是 。
(2)焙烧过程产生的SO2会造成污染,下列处理SO2的方法,不合理的是 。
A.高空排放 B.用纯碱溶液吸收制备亚硫酸钠
C.用氨水吸收后,再经氧化制备硫酸铵 D.用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3,加盐酸溶解后,后续处理过程中,未涉及到的操作有 。
A.过滤 B.加过量NaOH溶液 C.蒸发结晶 D.灼烧 E.加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示
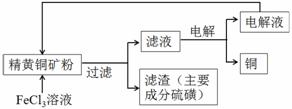
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为 。
(5)该工艺流程中,可以循环利用的物质是 (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极总反应式 。
(7)黄铜矿中含少量Pb,调节C1- 浓度可控制滤液中Pb2+的浓度,当c(C1-)=2mo1·L-1时溶液中Pb2+物质的量浓度为 mol·L-1。[已知KSP(PbCl2)=1 x 10-5]
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③ 量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
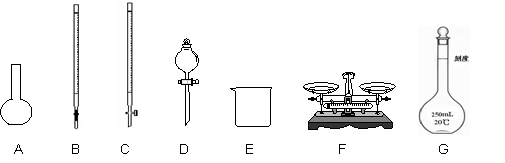
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E,F和 (填字母)。
(2)步骤②中加入盐酸的作用____________________________ ______。
(3)写出步骤④中发生反应的离子方程式 。
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
___Fe2+ + ___ClO3— + = __Fe3+ + ___Cl— + ___H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响).
(5)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g.
(6)本实验若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2 + 6NaOH  5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性在酸性溶液由强到弱的顺序是_________________________。
查看答案和解析>>
科目: 来源: 题型:
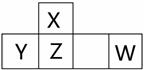 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。
(1) 写出W的原子结构示意图: 。
(2) X、Y、Z和W的最高价氧化物的水化物的酸性由强到强的顺序是
(3) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
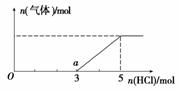 (5) 将W的气态氢化物通入一定量的NaOH溶液中,在所得 溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
(5) 将W的气态氢化物通入一定量的NaOH溶液中,在所得 溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com