
科目: 来源: 题型:
在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①②③ B.①②③⑤ C.②⑤ D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
以下反应可以用熵判据来解释的是
A.硫酸铜饱和溶液降低温度时有晶体析出
B.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H=+74.9kJ/mol
C.CaO(s)+CO2(g)==CaCO3(s) △H=-175.7kJ/mol
D.2H2(g)+O2(g) ==2H2O(l) △H=-285.8kJ/mol
查看答案和解析>>
科目: 来源: 题型:
同温同压下,已知下列各反应为放热反应,下列各热化学方程式中ΔH最小的是
A.2A(l)+B(l)===2C(g) ΔH1 B. 2A(g)+B(g)===2C(l) ΔH2
C.2A(g)+B(g)===2C(g) ΔH3 D.2A(l)+B(l)===2C(l) ΔH4
查看答案和解析>>
科目: 来源: 题型:
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在条件下,才会发生化学反应速率变化而化学平衡不移动的情况
查看答案和解析>>
科目: 来源: 题型:
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 ___ _____(填字母)。
(3) 常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
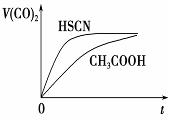 (4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
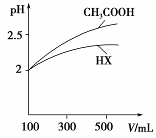 (5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),
c(CH3COO-)/c(CH3COOH)=________。
(7) 写出少量CO2通入次氯酸钠溶液中的离子方程式:
______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
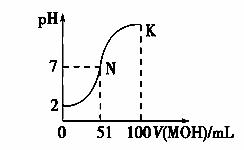
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中D是正确的,混合后溶液中的溶质为 。
(3)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则混合前a b(填“>”、“<”、或“=”), 用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目: 来源: 题型:
今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②
E.①>②=③ F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 。
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 。
(3)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(4)将pH相同的三种酸均稀释10倍后,pH关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com