
科目: 来源: 题型:
化学与能源开发、环境保护、资源利用、食品安全等密切相关。下列说法正确是
A.自来水生产中应尽量用明矾净化、消毒
B.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应
C.绿色化学的核心是利用化学反应原理治理环境污染
D.高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用
查看答案和解析>>
科目: 来源: 题型:
某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。
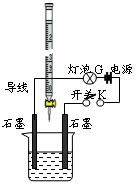 为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如右图所示的实验装置。
为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如右图所示的实验装置。
(1)实验时,烧杯中应盛 ▲ (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯
中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度
为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。
断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ▲ ,原因是 ▲ 。烧杯中得到的溶液pH= ▲ 。
(3) 若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 ▲ 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式 为____ ▲ ____。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是___ ▲ ___(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
查看答案和解析>>
科目: 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu + H2O |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
 Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是: __ ▲ ___
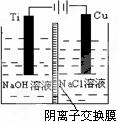
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米 Cu2O,装置如右图所示:该电池的阳极反应式为 __ ▲ ___
钛极附近的pH值 __ ▲ ___ (增大、减小、不变)
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ▲ ___
 (4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: △H>0。水蒸气的浓度随时间t变化如下表所示。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: △H>0。水蒸气的浓度随时间t变化如下表所示。
| 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 __ ▲ ___ (填字母)。
A.实验的温度:T2<T1 B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
查看答案和解析>>
科目: 来源: 题型:
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是____ ▲ ____;
②列式并计算该条件下反应的平衡常数K=____ ▲ ____。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率____ ▲ ____(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____ ▲ ____。(填字母)
A.SO2和SO3浓度相等 B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___ ▲ ____K(B)(填“>”、“<”或“=”)。
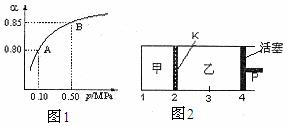
(3)如图2所示,保持温度不变,在一定反 应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲_ ▲ 乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__ _ ▲ ____填:“增大”、“减小”、“不变”、“无法确定”)
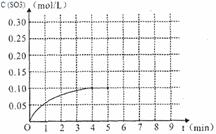 (4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
查看答案和解析>>
科目: 来源: 题型:
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。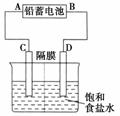 已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO
已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO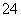 -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO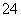 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式__ ▲ __ 。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为 ▲ __极。
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1. 15 g/cm3)时,
①若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为 ▲ __ L。
②若消耗硫酸amol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出) ▲ __ (用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
在一定容积的密闭容器中发生反应:X(g)+Y(g)  Z(g)+W(s);ΔH>0。若开始投入1 mol X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图像。下列有关判断正确的是
Z(g)+W(s);ΔH>0。若开始投入1 mol X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图像。下列有关判断正确的是
A.甲图表示温度对X转化率的影响,且Ⅰ温度较低
B.乙图一定表示压强对X体积分数的影响,且Ⅳ压强较高
C.甲图一定表示压强对X体积分数的影响,且Ⅰ压强较高
D.甲、乙图都可以表示温度、压强对平衡的影响,且Ⅰ>Ⅱ、Ⅲ<Ⅳ
查看答案和解析>>
科目: 来源: 题型:
关于浓度均为0.1 mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH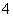 ):③>① B.水电离出的c(H+):②>①
):③>① B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH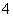 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
对室温下等pH、等体积的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.加入足量的苏打固体充分反应后,两溶液中产生的CO2一样多
C.加水稀释2倍后,两溶液的pH均减小
D.加足量的锌充分反应后,盐酸中产生的氢气速率快
查看答案和解析>>
科目: 来源: 题型:
pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是
A.HX可能是强酸 B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是弱酸 D.反应过程中二者生成H2的速率相同
查看答案和解析>>
科目: 来源: 题型:
为了除去MgCl2酸性溶性中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸。这种试剂是
A.NH3·H2O B.NaOH C.Na2CO3 D.MgO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com