
科目: 来源: 题型:
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是 ( )
A. 2F2+2H2O==4HF+O2 B. C+H2O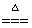 CO+H2
CO+H2
C. 2Na+2H2O==2NaOH+H2↑ D. Cl2+H2O==HCl+HClO
查看答案和解析>>
科目: 来源: 题型:
|
|
|
|
等)生产Ni2O3。其工艺流程为:
 |


图Ⅰ 图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为
。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
⑵工艺流程中“副产品”的化学式为 。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度
为 mol·L-1(常温时CaF2的溶度积常数为2.7×10-11)。抽滤装置中除了抽气泵、
安全瓶外,还需要的主要仪器有_____________________。
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
工业催化剂K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备:
2FeC2O4·2H2O + H2O2+ 3K2C2O4+ H2C2O4=2K3[Fe(C2O4)3]·3H2O
(1)[Fe(C2O4)3]3-的名称是_______________。
(2)制备过程要防止草酸被H2O2氧化,写出草酸被H2O2氧化的化学方程式__________。
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2+ + 4NH3  [Cu(NH3)4]2+,其稳定常数表达式为:
[Cu(NH3)4]2+,其稳定常数表达式为: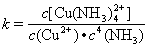 。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
(4)铁元素可形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂。经组成分析A仅含K、Fe、C、N四种元素。取36.8g A加热至400℃,分解成KCN、Fe3C、C、N2,生成的氮气折合成标准状况下的体积为2.24L,Fe3C质量是C质量的3倍,Fe3C物质的量是氮气物质的量的1/3。则A的化学式为____________________。
查看答案和解析>>
科目: 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯
化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪个氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则
溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含
所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实
验现象,证明了乙同学的观点是正确的。
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到得现象。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生
的离子反应方程式为 。
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
 某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的
质量(设为m1);③准确称量纯碱样
品的质量(设为n),放入广口瓶A
内;④打开分液漏斗a的旋塞,缓缓
滴入稀盐酸,至不再产生气泡为止;
⑤称量干燥管Ⅰ的质量(设为m2)。
(1)实验操作④要缓缓地进行,其理
由是________________。如果操作太快,会导致测定结果________(填偏大、偏小或不变)。(2)装置B的作用是_____________________;干燥管Ⅱ的作用是___________________。(3)根据甲同学的实验数据,写出计算纯碱样品纯度的公式_______________________
(4)方案评价:乙同学认为甲同学的方案有缺陷。乙同学认为稀盐酸要改为稀硫酸,否则
会导致测定结果偏大。你认为还有其它缺陷吗?如果有,提出你的改进意见或需要添加的实
验步骤,并指出甲同学缺少这一步骤会对结果产生什么影响(填偏大、偏小或不变),将答
案填入表中(不一定要填满)。
| 序号 | 改进意见 | 缺少时的影响 |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目: 来源: 题型:
元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数
占核外电子总数的3/4,W—、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周
期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)Z在元素周期表中的位置 ,工业上生产Z单质的化学方程式为
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH
均大于7,组成元素的原子数目比均为1∶1∶1。若A能抑制水的电离,而B能促进水的电
离,则A、B的化学式分别为 、 。
(3)C是由上述四种元素的两种组成的相对分子质量为34的化合物,则C的电子式 。
(4)用B在碱性条件下可以处理CN—的工业废水,请将下列6种微粒:CN—、CO32—
N2、OH—、B的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式: + + ═ + + + H2O
查看答案和解析>>
科目: 来源: 题型:
将13.0g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标况)。另取等质量的合金溶于过量的稀硝酸中生成6.72L(标况)NO,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量是
A.11.85g B.12.7g C.27.45 g D.28.3g
查看答案和解析>>
科目: 来源: 题型:
操作1:将1 L 1.00 mol·L-1的Na2CO3溶液逐滴加入到1 L 1.25 mol·L-1的盐酸中;操作2:将1 L 1.25 mol·L-1的盐酸逐滴加入1 L 1.00 mol·L-1 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是
A.5∶2 B.2∶5 C.1∶1 D.2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com