
科目: 来源: 题型:
下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是( )
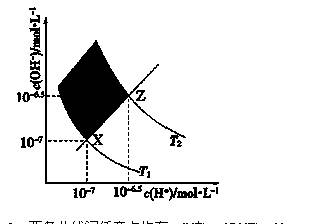
A.两条曲线间任意点均有c(H+)×c(OH-)=KW
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目: 来源: 题型:
下列物质、类别、用途或储存方法对应关系正确的是( )
| A. Na2CO3 | B. CH3COOH | C. NH3·H2O | D. Na2SiO3 |
| 碱 | 弱电解质 | 混合物 | 正盐 |
|
|
|
|
带玻璃塞的试剂瓶 |
查看答案和解析>>
科目: 来源: 题型:
“分类”的思想方法,在化学发展中起到了重要作用.下列分类标准合理的是 ( )
A. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
B.只含一种元素的物质一定是单质
C.溶于水后能电离出H+的化合物都为酸
D.有单质生成的反应一定是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
下列有关微粒之间关系和特征描述正确的是( )。
| 选项 | 微粒 | 相互关系 | 特征描述 |
| A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
| B | 新戊烷、2,2-二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
| C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
| D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
查看答案和解析>>
科目: 来源: 题型:
全球气候变暖已经成为全世界人类面临的重大问题。
(1)地球上的能主要于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ:H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ/mol
Ⅱ:CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ/mol
Ⅲ:12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
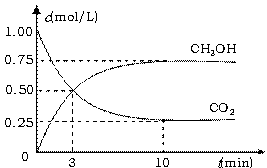
(2)工业上有一种方法有效地开发利用CO2,是用CO2生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)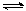 CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min);
②氢气的转化率= ;
③求此温度下该反应的平衡常数K= ;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1 c2的关系(填>、<、=)。
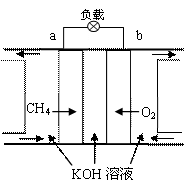
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如上图右所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液,从而达到吸收CO2的目的。
① 通入氧气一极的电极反应式为 ;
② 随着电池不断放电,电解质溶液的pH
(填“增大”、“减小”或“不变”)。
③通常情况下,甲烷燃料电池的能量利用率
(填大于、小于或等于)甲烷燃烧的能量利用率。
查看答案和解析>>
科目: 来源: 题型:
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。
(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为 mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A. KBr B. KI C. K2S D. K2CrO4
查看答案和解析>>
科目: 来源: 题型:
已知:(A)Cu2+,Fe2+在pH为4~5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,溶液的pH是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
(1)②中发生反应的离子方程式是 。
(2)③中过滤后滤渣的成分是 。
(3)①③中如何用pH试纸测定溶液的pH值: 。
(4)③中pH升高的原因是: 。(用离子方程式表示)
查看答案和解析>>
科目: 来源: 题型:
(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
① 电极X的材料是 ;
② 外电路中的电子是从 电极流向 电极(填电极材料名称或符号)。
③ 在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是 (填离子符号)。
(2)① 金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式: 。
② 为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③ 图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电的 极。
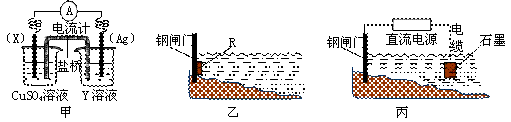
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
① 若此蓄电池放电时,该电池某一电极发生还原反应的物质是 (填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
② 该电池放电时,正极附近溶液的PH (填增大、减小、不变)
③ 充电时该电池阳极的电极反应式 。
查看答案和解析>>
科目: 来源: 题型:
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+。下列说法中正确的是
A.充电时的总反应为FePO4+Li=LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com