
科目: 来源: 题型:
把煤作为燃料可通过下列两种途径。
途径Ⅰ:C(s)+O2(g)====CO2(g) ΔH=-Q1 kJ·mol-1
途径 Ⅱ:先制水煤气: C(s)+H2O(g)====CO(g)+H2(g) ΔH=+Q2 kJ·mol-1
再燃烧水煤气:2CO(g)+O2(g)====2CO2(g);2H2(g)+O2(g)====2H2O(g)
ΔH=-Q3 kJ·mol-1
试回答下列问题:
(1)途径Ⅰ放出的热量________(填“>”“=”或“<”)途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是_____ __________。
__________。
(3)由于制取水煤气的反应里,反应物所具有的总能量____________(填“>”“=”或“<”)产物所具有的总能量,因此在化学反应里,反应物就需要_______能量才能转化为产物,因此其反应条件为_________ __________________________。
__________________________。
查看答案和解析>>
科目: 来源: 题型:
甲醇是一种新型的汽车动力燃料,工业上可通过CO(CO的结构式为
C≡O)和H2化合制备甲醇,该反应的热化学方程式为
①CO(g)+2H2(g)====CH3OH(g) ΔH1
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为
②CO(g)+1/2O2(g)====CO2(g) ΔH2=-283 kJ·mol-1
③H2(g)+1/2O2(g)====H2O(g) ΔH3=-242 kJ·mol-1
断开1 mol某些化学键所需的最低能量数据如下表,请回答下 列问题:
列问题:

(1)反应① 的焓变ΔH1=_________。
的焓变ΔH1=_________。
(2)CH3OH(g)燃 烧生成CO2(g)和H2O(g)的热
烧生成CO2(g)和H2O(g)的热 化学方程式为CH3OH(g)+3/2O2(g)
化学方程式为CH3OH(g)+3/2O2(g)
====CO2(g)+2H2O(g) ΔH4,该反应的焓变ΔH4=______________________。
与CO和H2相比,甲醇作为汽车动力燃料的优点是_______________________。
查看答案和解析>>
科目: 来源: 题型:
化学反应N2+3H2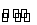 2NH3的能量变化如图所示,该反应的热化学方程式是
2NH3的能量变化如图所示,该反应的热化学方程式是
( )

A.N2(g)+3H2(g)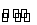 2NH3(l) ΔH=2(a-b-c) kJ·mol-1
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)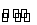 2NH3(g) ΔH=2(b-a) kJ·mol-1
2NH3(g) ΔH=2(b-a) kJ·mol-1
C.1/2N2(g)+3/2H2(g)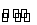 NH3(l) ΔH=(b+c-a) kJ·mol-1
NH3(l) ΔH=(b+c-a) kJ·mol-1
D.1/2N2(g)+3/2H2(g)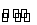 NH3(g) ΔH=(a+b) kJ·mol-1
NH3(g) ΔH=(a+b) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
在25 ℃、1.01×105 Pa下,将22 g CO2通入1 mol·L-1 NaOH溶液750 mL中充分反应,测得反应放出x kJ热量。在该条件下,1 mol CO2 通入2 mol·L-1 NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
通入2 mol·L-1 NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
A.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.CO2(g)+NaOH(l)====NaHCO3(l) ΔH=-(8x-2y) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.已知反应X+Y====M+N为放热反应,则该反应不必加热就可发生
B.能源是提供能量的资源,它包括化石燃料(煤、石油、天然气),不包括阳光、海水
C.对于同一 个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.在一个确定 的化学反应关系中,反应物的总能量总高于生成物的总能量
的化学反应关系中,反应物的总能量总高于生成物的总能量
查看答案和解析>>
科目: 来源: 题型:
已知铝与O2、O3在一定条件下均能反应,且都生成Al2O3。反应的热化学方程式如下
4Al(s)+3O2(g)====2Al2O3(s) ΔH=-Q1 kJ·mol-1
4Al(s)+2O3(g)====2Al2O3(s) ΔH=-Q2 kJ·mol-1。
Q1 、Q2均大于0,且Q1 <Q2,下列说法正确的组合是( )
①上述两个反应均为吸热反应;
②4 mol固态Al和3 mol气态O2所具有的总能量大于2 mol固态Al2O3所具有的能量;
③ 等质量的O2、O3,O2
等质量的O2、O3,O2 的能量高;
的能量高;
④等物质的量的O2、O3,O3的能量高;
⑤由O2生成O3的反应为放热反应;
⑥由O2生成O3的反应为吸热反应。
A.①②④ B.②④⑥ C.②③⑤ D.③④⑥
查看答案和解析>>
科目: 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是( )
A.反应产物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)====2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目: 来源: 题型:
在标准状况下进行下列实验:甲、乙、丙各取30 mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)盐酸的物质的量浓度是多少?
(2)求合金中镁、铝的质量分数。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO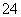 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
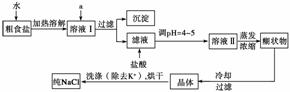
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO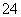 离子,选出a所代表的试剂,按滴加顺序依次为______________________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为______________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,先用的试剂为__________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外,还有__________(填仪器名称)。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4===ZnSO4+H2↑
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置:
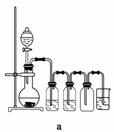

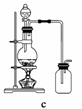
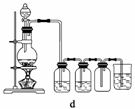
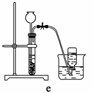
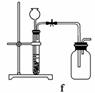
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com