
科目: 来源: 题型:
X、Y、Z、W为四种短周期主族元素,其中X、Z
同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由小到大的顺序为: X< Z < Y
C.Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
查看答案和解析>>
科目: 来源: 题型:
下图为短周期的一部分,Y原子最外层电子数
是其电子层数的2倍,下列说法正确的是( )
A.Y的氢化物比Z的氢化物稳定
B.原子半径大小顺序是X >Y>R
C.Y、R形成的化台物YR2能使酸性KMnO4溶液褪色
D.四种元素中最高价氧化物的水化物的酸性最强的是Y

查看答案和解析>>
科目: 来源: 题型:
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
A、若 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D、若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应

查看答案和解析>>
科目: 来源: 题型:
四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A.与W相邻的同主族元素可制成重要的半导体材料
B.X单质不可能置换出W单质
C.元素原子半径从大到小的顺序是X、Y、Z
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.含有离子键和共价键的化合物一定是离子化合物
B.元素原子的最外层电子数等于该元素的最高正化合价
C.目前人们已发现的元素种类数目与原子种类数目相同
D.多电子原子中,在离核较近的区域内运动的电子能量较高
查看答案和解析>>
科目: 来源: 题型:
短周期元素离子aA2+、bB+、cC3-、dD-都具有相
同电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>CB.原子序数d>c>b>a
C.离子半径C>D>B>AD.单质还原性A>B>D>C
查看答案和解析>>
科目: 来源: 题型:
2006年10月16日,美国劳伦斯·利弗莫尔国家实验室宣布,美、俄科学家合作,用大量钙-48离子轰击人造元素锎-249,合成了3个新原子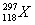 ,其存在时间只有0.9毫秒.下列关于
,其存在时间只有0.9毫秒.下列关于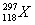 的说法不正确的是( )
的说法不正确的是( )
A.制造出的新的118号元素的一个原子中子数为179,则该原子的质量数为297
B.该元素X应该位于元素周期表的0族元素氡之下
C.该元素X属于过渡金属元素
D.118号元素的一个原子释放出一颗由两个质子和两个中子组成的阿尔法粒子后,衰变为已知的116号元素的原子,该过程不属于化学变化
查看答案和解析>>
科目: 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
| ||||||||||||||||
|
| ② |
| ③ | ④ | ⑤ | ⑥ |
| ||||||||||
|
| ⑦ |
| ⑧ |
|
|
|
| ||||||||||
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑤的轨道表示式_______,元素⑨原子的核外电子排布式__________。
(2)元素第一电离能的大小比较:④_____⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④_____⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式_________。
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(4)上述③与④元素组成的(CN)2化合物中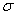 键与
键与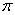 键之比________。
键之比________。
(5)⑦的氧化物是优良的耐高温材料,它的熔点比 CaO高,其原因是_____________。
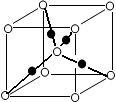
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式________。
查看答案和解析>>
科目: 来源: 题型:
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 。
(2)Y的最高价氧化物晶体类型是 晶体。X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) 。
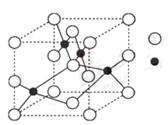
(3)右图是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。(图中实心球表示W元素)
(4)铜元素和W元素都位于周期表的ds区,胆矾
CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如右,有关它的说法正确的是 ________(填字母)。
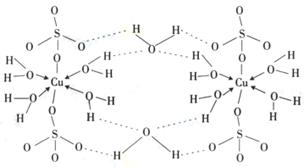
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com