
科目: 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是( )
A、30 g SiO2含有NA个Si-O共价键
B、1 L 0.2mol·L-1 Al2(SO4)3溶液中的离子总数为NA
C、标准状况下,22.4 L H2O所含原子个数大于3NA
D、含4 mol HCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素。A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为 ;
(2)用离子方程式表示G 的非金属性比F强 ;
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ;
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为 ,X与水反应的产物名称是
;
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 mol·L-1的NaOH溶液完全反应生成正盐,则燃烧1mol B2A2放出的热量为 KJ;
(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位mol·L-1)。要使c(E2+) 为0.001 mol·L-1的溶液形成沉淀,则溶液的PH值至少升高到 。


查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.含有离子键和共价键的化合物一定是离子化合物
B.元素原子的最外层电子数等于该元素的最高正化合价
C.目前人们已发现的元素种类数目与原子种类数目相同
D.多电子原子中,在离核较近的区域内运动的电子能量较高
查看答案和解析>>
科目: 来源: 题型:
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 。
(2)Y的最高价氧化物晶体类型是 晶体。X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) 。
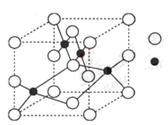
(3)右图是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。(图中实心球表示W元素)
(4)铜元素和W元素都位于周期表的ds区,胆矾
CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如右,有关它的说法正确的是 ________(填字母)。
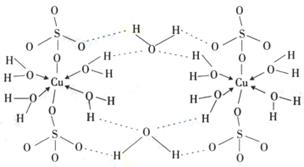
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II. 将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV. TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。
|

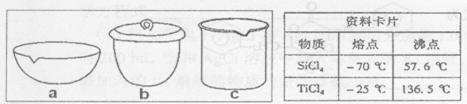
②如实验IV中,应将TiO2.xH2O放在_______ (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的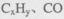 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为P g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
| |
 + H2O2+ H+= Mn2++ H2O+
+ H2O2+ H+= Mn2++ H2O+ ②滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________。
③重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是 ( )
A. A、B、C、D、E B. E、C、D、B、A C. B、A、D、C、E D. C、D、A、B、E
查看答案和解析>>
科目: 来源: 题型:
短周期元素离子aA2+、bB+、cC3-、dD-都具有相
同电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>CB.原子序数d>c>b>a
C.离子半径C>D>B>AD.单质还原性A>B>D>C
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A顺序依次减小,B和E同主族。下列推断不正确的是 ( )
A、A、B、E一定在不同周期 B、C的最高价氧化物的水化物可能显碱性
C、A、D可能在同一主族 D、C和D的单质可能化合形成离子化合物
查看答案和解析>>
科目: 来源: 题型:
镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是( )
A 在化合物中呈+2价 B 单质使水分解、放出氢气
C 氢氧化物呈两性 D 碳酸盐难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com