
科目: 来源: 题型:
X为某金属矿的主要成分,X具有下列转化关系(部分反应物、生成物没有列出)。

已知:1 mol X经一系列变化只生成A、B、C,且物质的量之比为1∶2∶1,X不含氧元素。请回答:
(1)X的化学式为________;
(2)写出物质A名称________;物质G名称:________;
(3)写出下列反应方程式:
C+E—→B+F__________________________________;
生成红色沉淀G___________________________________
___________________________ ______________________;
______________________;
(4)工业生产纯净C的方法是________;其阴极电极反应式是:________;
(5)已知反应②的热化学方程式为:2B(g)+O2(g)2D(g) Δ<0
该反应平衡常数表达式为:________;
升高温度 K值的变化是:________。(填“变大”、“变小”或“不变”)
K值的变化是:________。(填“变大”、“变小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
海水中不仅含有丰富 的非金属元素资源(如氯、溴、碘等),还含有丰富的金属元素资源(如Na、Mg、Fe、Cr等)。
的非金属元素资源(如氯、溴、碘等),还含有丰富的金属元素资源(如Na、Mg、Fe、Cr等)。
(1)海水晒盐的原理是:________;写出氯化钠的电子式:________;与Na、Cl同周期,且简单离子半径最小的离子结构示意图:________。
(2)晒出的粗盐常混有MgSO4、CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:①溶解,②________,③加过量Na2CO3溶液,④________,⑤过滤除去杂质,⑥________,⑦蒸发结晶。
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+、Cr3+等,为富集镁使其转化为MgCl2晶体,必须除去这些杂质离子。
有关资料:
| M(OH) | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mg(OH)2 | 9.5 | 11.0 |
| Cr(OH)3 | 4.3 | 5.0 |
为了有效除去杂质离子,又不引入新的杂 质离子,且能满足“绿色化学理念”,则最佳试剂选择和操作是:
质离子,且能满足“绿色化学理念”,则最佳试剂选择和操作是:
①先加________,目的是________;
②再加________,目的是________;
③过滤后,为能得到纯净的MgCl2晶体,采用的操作方法是:
_______________ __________________________________
__________________________________
__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。

(2)写出C物质的化学式:________。
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:____________________________;
反应④的离子方程式:____________________________;
反应⑥的化学方程式:____________________________。
(4)从能量变化的角度看,反应①②③中,属于Δ<0的反应是________(填序号)
查看答案和解析>>
科目: 来源: 题型:
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知:2Fe2++B r2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。则下列有关说法中,不正确的是( )
r2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。则下列有关说法中,不正确的是( )
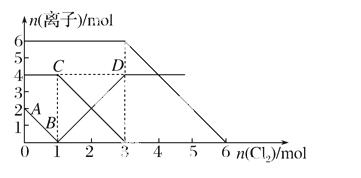
A. 线段表示Fe3+物质的量的变化
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D. 原溶液中:(Fe2+)∶(I-)∶(Br-)=2∶1∶3
查看答案和解析>>
科目: 来源: 题型:
将Na2O2逐渐加入到含有Al3+、Mg2+、NH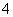 的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示,则原溶液中Al3+、Mg2+、NH
的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示,则原溶液中Al3+、Mg2+、NH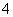 的物质的量分别为 ( )
的物质的量分别为 ( )

A.2 mol、3 mol、8 mol B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol D.3 mol、2 mol、4 mol
查看答案和解析>>
科目: 来源: 题型:
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目: 来源: 题型:
常温下,将1.92 g铜加入到100 mLH2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448 mL(标准状况)的氢气。下列有关结论不正确的是( )
A. 溶解的铁粉为2.8 g
B. 原溶液中(SO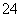 )=0.5 mol·L-1
)=0.5 mol·L-1
C. 原混合溶液中(H+)=1.2 mol·L-1
D. 原溶液中(NO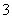 )=0.08 mol
)=0.08 mol
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能含有H+、Na+、NH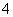 、Mg2+、Fe3+、Al3+、SO
、Mg2+、Fe3+、Al3+、SO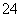 、CO
、CO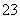 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )
等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )

A.原溶液中含有的阳离子是H+、NH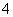 、Mg2+、Al3+
、Mg2+、Al3+
B.原溶液中一定含有SO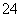 和Na+
和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
D.反应最后形成的溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目: 来源: 题型:
所谓合金,就是不同种金属(也包括一些非金属)在熔融状态下形成的一种熔合物。根据下列四种金属的熔、沸点,判断其中不能形成合金的是( )
| Na | Cu | Al | Fe | |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2200 | 3000 |
A. Cu和Al B. Fe和Cu
C. Fe和Na D. Al和Na
查看答案和解析>>
科目: 来源: 题型:
下列类比关系正确的是( )
A. AlCl3与过量NaOH溶液反应生成AlO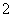 ,则与过量NH3·H2O也生成AlO
,则与过量NH3·H2O也生成AlO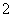
B. Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C. Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D. Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com