
科目: 来源: 题型:
下列装置应用于实验室由粗铜制取NO2气体并回收硝酸铜的实验,能达到实验目的的是
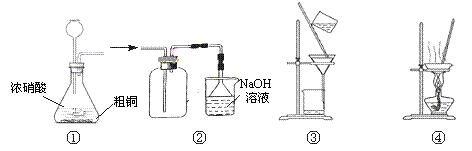
A.用图①装置制备NO2
B.用图②装置收集NO2
C.用图③装置,过滤时不断搅拌溶液以过滤除去固体杂质
D.用图④装置,蒸发至干得纯净的Cu(NO3)2·3H2O
查看答案和解析>>
科目: 来源: 题型:
下列指定反应的离子方程式正确的是
A.FeCl3溶液中加入过量的锌粉:Zn +2Fe3+=Zn2++2Fe2+
B.NH4Al(SO4)2中加入过量的NaOH溶液:Al3++4OH-=AlO2-+2H2O
C.(CH3COO)2Ba中加入稀硫酸:Ba2+ + SO42- = BaSO4↓
D.用惰性电极电解Cu(NO3)2溶液:2Cu2+ +2H2O  2Cu+ O2↑+ 4H+
2Cu+ O2↑+ 4H+
查看答案和解析>>
科目: 来源: 题型:
下列物质性质与应用对应关系正确的是
A.氨气具有碱性,可用作制冷剂
B.二氧化硅能与氢氟酸反应,可用于生产光导纤维
C.铝具有良好导电性和耐腐蚀性,可用于制作高压输电线
D.二氧化铅具有强氧化性,可用于铅蓄电池的负极材料
查看答案和解析>>
科目: 来源: 题型:
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Ca2+、K+、HCO3-、Cl-
C.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl-
D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
2014年5月中美科学家研究发现,常温下氢气分子可以在碳纳米管内与水形成氢气水合物,其原理类似于可燃冰的形成,这项研究有望能洁净安全地储存氢气。下列说法正确的是
A.碳纳米管以水合物储存氢气属化学变化
B.碳纳米管与金刚石互为同素异形体
C.氢气水合物与可燃冰是同一物质
D.氢气与纳米管内的水分子形成共价键
查看答案和解析>>
科目: 来源: 题型:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入5mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
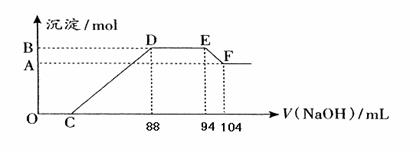
(1)B与A的差值为: mol
(2)原硝酸溶液中含硝酸的物质的量为: mol。
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为:
(4)写出铝与该浓度硝酸反应的离子方程式:
查看答案和解析>>
科目: 来源: 题型:
将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示。F和J是中学化学中常见的两种单质。H为红棕色气体。图中部分反应条件及生成物没有列出。请按要求填空:
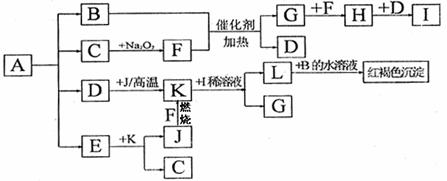
(1)单质F的化学式
(2)写出B和F反应的化学方程式 ,L和B的水溶液反应的离子方程式 ;
(3)写出K与I的稀溶液反应的离子方程式
(4)A的化学式为
(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4,反应有G生成,该反应的化学方程式是
查看答案和解析>>
科目: 来源: 题型:
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH 、Cl-、CO
、Cl-、CO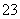 、SO
、SO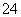 ,现分别取100 mL的两等份溶液进行如下实验:
,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)综合以上实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(2)写出②中产生沉淀的离子方程式 。
(3)某同学通过分析认为该溶液中K+一定 (填“存在”或“不存在”),他的理由是 。
查看答案和解析>>
科目: 来源: 题型:
两个化学兴趣小组进行了以下探究活动:
第一组:为研究铁质材料与热浓硫酸的反应,
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为 。
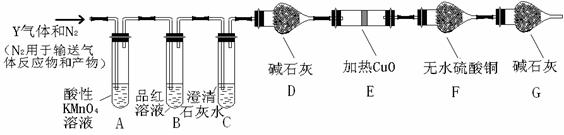 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(2)写出产生CO2的化学方程式 。
(3)装置A中试剂的作用是 ,反应的离子方程式 。
(4)简述确认气体Y中含有CO2的实验现象 。
(5)如果气体Y中含有H2,预计实验现象应是 。
第二组:拟用下列装置定量分析空气中SO2的含量:
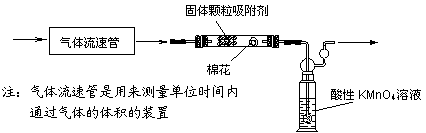
(6)KMnO4溶液中导管末端做成球状多孔结构的作用是
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 g/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com