
科目: 来源: 题型:
在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应.所得溶液中Fe2+能被标准状况下112mL氯气氧化.则原混合物中金属元素和氧元素的原子个数之比为( )
|
| A. | 5:7 | B. | 4:3 | C. | 3:4 | D. | 9:13 |
查看答案和解析>>
科目: 来源: 题型:
下列反应中,有沉淀产生且不会消失的是( )
|
| A. | 向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
|
| B. | 将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
|
| C. | 向AlCl3溶液中逐滴滴入稀硫酸 |
|
| D. | 将氨水逐滴滴入硝酸银溶液中,直至过量 |
查看答案和解析>>
科目: 来源: 题型:
若溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,满足此条件的溶液中一定可以大量共存的离子组是( )
|
| A. | Al3+ Na+NO3﹣ Cl﹣ | B. | K+ Na+Cl﹣ NO3﹣ |
|
| C. | K+ Na+ Cl﹣AlO2﹣ | D. | K+ NH4+ SO42﹣NO3﹣ |
查看答案和解析>>
科目: 来源: 题型:
根据下列物质的化学性质,判断其应用错误的是( )
|
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 |
|
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 |
|
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
|
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目: 来源: 题型:
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g)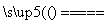 TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
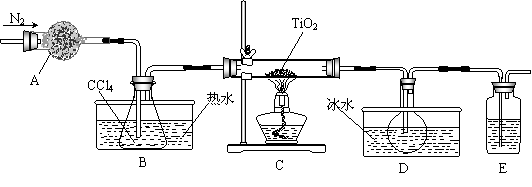

有关物质性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
|
水解 TiOSO4(aq)+ 2H2O(l)== H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
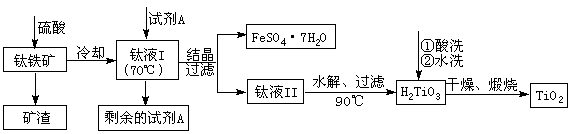
①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
查看答案和解析>>
科目: 来源: 题型:
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
| 甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
| 乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ,再 。
查看答案和解析>>
科目: 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反
应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O 下表列出了相关金
属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Al3+ | 3. 0 | 5. 0 |
| Fe2+ | 5. 8 | 8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
 (3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚 铁晶体。分离过程中加入无水乙醇的目的是
。
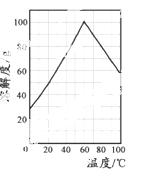
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先 制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4 溶液, ,得到FeSO4·7H2O 晶体。
查看答案和解析>>
科目: 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 。
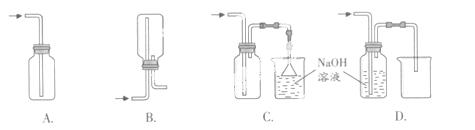
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
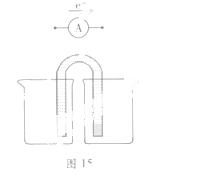
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选
作阳极。
查看答案和解析>>
科目: 来源: 题型:
制备氮化镁的装置示意图如下:
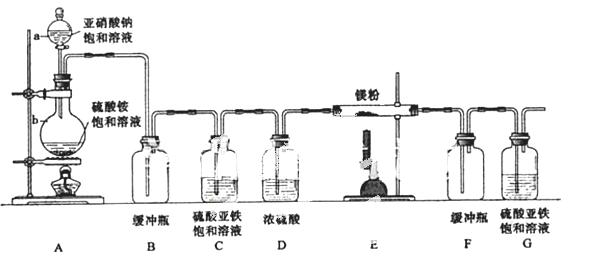
回答下列问题:
(1)检查装置气密性的方法是 ,
a的名称是 ,b的名称是 ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;
(4)写出E中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现
象 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com