
科目: 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应式:________________________。
(2)某学生认为,铁电极可能参与反应,并对产物做出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3:____________________________________________________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol/L FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红。
据②、③、④现象得出的结论是____________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:________。
Ⅱ.利用如图所示装置做电解50 mL 0.5 mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO );
);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:
①_________________________________________________________;
②_________________________________________________________。
(2)分析实验记录B中浅蓝色固体可能是________(写化学式),试分析生成该物质的原因:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
按如图所示装置连接,X、Y均为惰性电极。请回答下列问题:
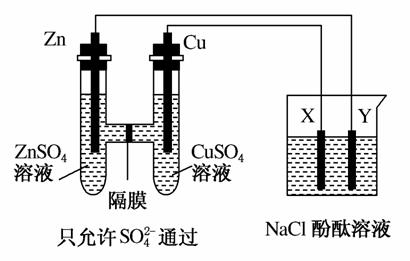
(1)Zn为________极。
(2)连接好装置后,烧杯中的溶液发生反应的离子方程式是_________。
(3)图中通过隔膜的SO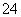 向________(填“左”、“右”或“不”)迁移,Y极及其附近出现的现象是________。
向________(填“左”、“右”或“不”)迁移,Y极及其附近出现的现象是________。
(4)常温下,当Zn极质量减少32.5 g时,X极生成气体8.4 L(标准状况),若此时烧杯中溶液的体积为500 mL,则此时烧杯中溶液的pH=________(不考虑生成的气体溶于水)。
查看答案和解析>>
科目: 来源: 题型:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
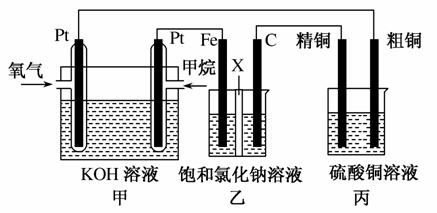
(1)甲烷燃料电池负极反应式是__________________。
(2)石墨(C)极的电极反应式为__________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L;丙装置中阴极析出铜的质量为________g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________。
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目: 来源: 题型:
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO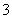 还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
①N2的结构式为________。
②上述反应离子方程式为________________,其平均反应速率v(NO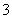 )为________mol·L-1·min-1。
)为________mol·L-1·min-1。
③还原过程中可生成中间产物NO ,写出3种促进NO
,写出3种促进NO 水解的方法__________________________。
水解的方法__________________________。
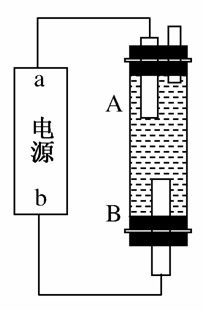
(2)电化学降解NO 的原理如图所示。
的原理如图所示。
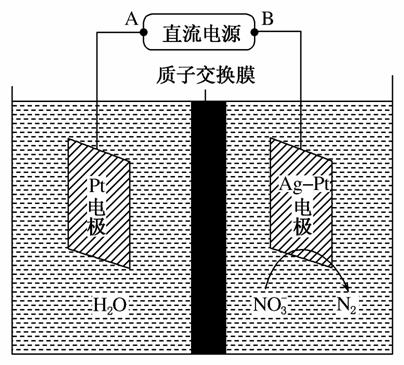
①电源正极为________(填“A”或“B”),阴极反应式为____________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目: 来源: 题型:
如图所示,用铁棒和石墨棒作电极电解1 L 1 mol/L的食盐水,下列有关说法正确的是( )
A.电键K与N连接,铁棒被保护而免受腐蚀
B.电键K与N连接,正极反应式为4OH--4e-===2H2O+O2↑
C.电键K与M连接,当两极共产生标准状况下气体33.6 L时,理论上生成1 mol NaOH
D.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜
查看答案和解析>>
科目: 来源: 题型:
如图所示 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路后发现
为电镀槽。接通电路后发现 上的c点显红色。为实现铁上镀锌,接通
上的c点显红色。为实现铁上镀锌,接通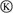 后,使c、d两点短路。下列叙述不正确的是( )
后,使c、d两点短路。下列叙述不正确的是( )
A.a为直流电源的正极
B.c极发生的反应为2H++2e-===H2↑
C.f极为锌板
D.e极发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC的工作原理如图所示。下列有关说法正确的是( )
A.当有0.1 mol电子转移时,a电极产生2.24 L H2
B.b电极上发生的电极反应式为4H2O+4e-===2H2↑+4OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应式为O2+4H++4e-===2H2O
查看答案和解析>>
科目: 来源: 题型:
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是( )
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-===Fe3+
C.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L
查看答案和解析>>
科目: 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )
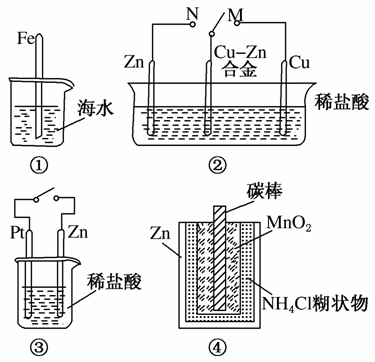
A.图①中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图②中,开关由M改置于N时,CuZn合金的腐蚀速率减小
C.图③中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图④中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com