
科目: 来源:同步题 题型:实验题
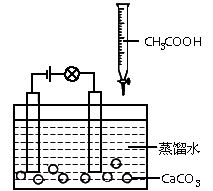
查看答案和解析>>
科目: 来源:同步题 题型:实验题
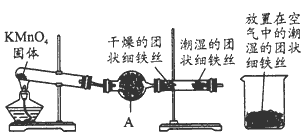
查看答案和解析>>
科目: 来源:同步题 题型:实验题
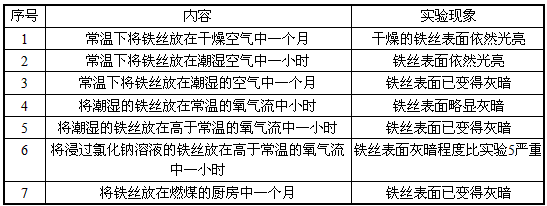
查看答案和解析>>
科目: 来源:同步题 题型:实验题
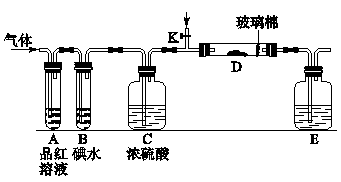
查看答案和解析>>
科目: 来源:辽宁省同步题 题型:实验题
查看答案和解析>>
科目: 来源:同步题 题型:实验题
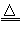 2KNO2+O2↑
2KNO2+O2↑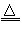 2CuO+2NO2↑+O2↑,4AgNO3
2CuO+2NO2↑+O2↑,4AgNO3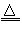 4Ag+4NO2↑+O2↑
4Ag+4NO2↑+O2↑ 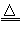 M(NO2)2+O2↑
M(NO2)2+O2↑ 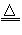 2MO+4NO2↑+O2↑
2MO+4NO2↑+O2↑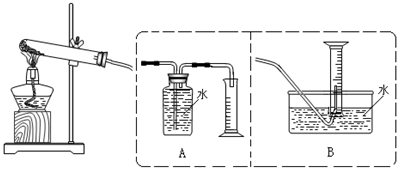
查看答案和解析>>
科目: 来源:专项题 题型:实验题
查看答案和解析>>
科目: 来源:专项题 题型:实验题
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH== ________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为__________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)
①提出合理假设。
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:____________。
②设计实验方案,进行实验。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、淀粉-KI溶液、紫色石蕊试液。

查看答案和解析>>
科目: 来源:专项题 题型:实验题
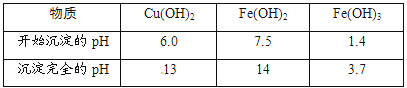
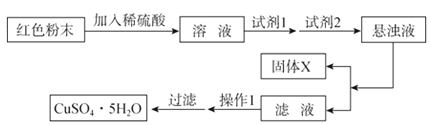
查看答案和解析>>
科目: 来源:专项题 题型:实验题
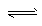 2CO2+N2
2CO2+N2 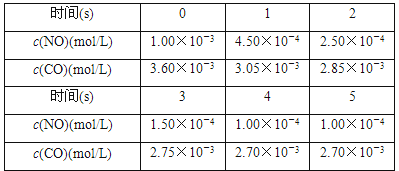
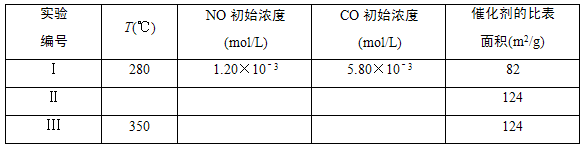
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com