
科目: 来源: 题型:
下列化学用语表达正确的是( )
A.乙酸的分子填充模型图:
B.聚丙烯结构简式:CH2—CH—CH2
C.醛基的结构简式:—COH
D.乙烯的结构简式:CH2CH2
查看答案和解析>>
科目: 来源: 题型:
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4- +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中
c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42 -)≥ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 (填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量 g/mL(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe (s)+3CO(g) ΔH 1=+489.0 kJ· mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1, 则CO还原Fe2O3(s)的热化学方程式为 。
(2)CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为 。
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) 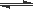 CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。
CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。
|

①该反应的ΔH 0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为
KⅠ KⅡ (填“>、=或<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a molCO2、3a molH2、 b molCH3OH(g)、b molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图6。在0~15小时内,CH4的平均生成速率I、II和III从小到大的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图7。
①当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) 0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= mol·L-1,c (H+) − c (MOH) = mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH 7(填“>、<或=”)。
查看答案和解析>>
科目: 来源: 题型:
已知:2SO3 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2 mol SO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2 mol SO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A B(大于;等于;小于);达平衡时SO3的转化率
A B(大于;等于;小于)。
(2)若平衡后,向A、B中分别充入惰性气体, 容器的平衡将向 方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A ,B
查看答案和解析>>
科目: 来源: 题型:
下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:
c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:
c(CN-)+2c(OH-)=2c(H+)+c(HCN)
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+ )+c(NH3·H2O)+c(Fe2+)=0.3 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )
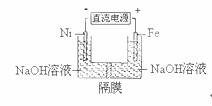
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42 -+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目: 来源: 题型:
室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线,如图2所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
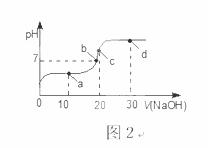
A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -)
B.b点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-)
C.c点时:c(OH-)=c(CH3COOH) +c(H+)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
25 ℃时,20.00 mL硫酸和硝酸的混合溶液,加入足量的氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466 g沉淀。滤液跟2 mol/L NaOH溶液反应,用去10.00 mL碱液时恰好中和。下列说法中正确的是( )
A.原混合液中c(SO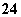 )=0.2 mol/L B.原混合液中c(NO
)=0.2 mol/L B.原混合液中c(NO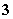 )=0.9 mol/L
)=0.9 mol/L
C.原混合液中pH=0 D.原混合液中由水电离出的c(H+)=0.1 mol/L
查看答案和解析>>
科目: 来源: 题型:
在恒容的密闭容器中,可逆反应X(s)+3Y(g)  2Z(g);ΔH>0,达到平衡时,下列说法正确的是( )
2Z(g);ΔH>0,达到平衡时,下列说法正确的是( )
A.充入少量He使容器内压强增大,平衡向正反应方向移动
B.升高温度,平衡向正反应方向移动,平均分子量变小
C.继续加入少量X,X的转化率减小,Y的转化率增大
D.继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com