
科目: 来源: 题型:
下列描述中正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B.中和反应都是放热反应
C.放热反应的反应速率总是大于吸热反应的反应速率
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的 不同
不同
查看答案和解析>>
科目: 来源: 题型:
下列关于物质的作用和性质的说法不正确的是 ( )
A.盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥
B.Al3+能水解为Al(OH)3胶体,明矾可用作净水剂
C.碳酸钠溶液显碱性,常用来制胃酸
D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
查看答案和解析>>
科目: 来源: 题型:
被称之为“软电池”的纸质电池总反应为Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是 ( )
A.该电池中Zn作负极,发生还原反应
B.该电池反应中MnO2起催化作用
C.该电池工作时电流由Zn经导线流向MnO2
D.该电池正极反应式为:MnO2+e-+H2O=MnOOH+OH-
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.NaHCO3水解的离子方程式为:HCO3- + H2O CO32- + H3O+
CO32- + H3O+
D.NaHSO3属于强碱弱酸盐,其水溶液一定显碱性
查看答案和解析>>
科目: 来源: 题型:
常温下,下列溶液中各组离子一定能大量共存的是 ( )
A.使甲基橙呈红色的溶液中:Na+、AlO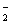 、NO
、NO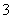 、CO
、CO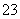
B.由水电离产生的c(H+)=10-12mol·L?-1的溶液:NH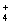 、SO
、SO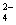 、HCO
、HCO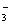 、Cl-
、Cl-
C.含有0.1 mol·L-1 HCO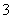 的溶液:Na+、Fe3+、NO
的溶液:Na+、Fe3+、NO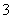 、SCN-
、SCN-
D. 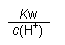 =0.1 mol·L-1的溶液:Na+、K+、CO
=0.1 mol·L-1的溶液:Na+、K+、CO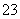 、NO
、NO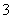
查看答案和解析>>
科目: 来源: 题型:
下列化学实验事实及解释都正确的是 ( )
A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力
B.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数
C.等体积、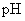 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说
都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说
明酸性: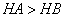
D.向浓度均为0.1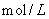 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成
的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成
Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。
查看答案和解析>>
科目: 来源: 题型:
下列事实不能用勒夏特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.用排饱和食盐水法收集氯气
查看答案和解析>>
科目: 来源: 题型:
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq)I2(aq)+H2O(l) ΔH3
总反应的化学方程式为__________________,其反应热ΔH=_______。

(2)在溶液中存在化学平衡:I2(aq)+I-(aq)I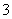 (aq),其平衡常数表达式为________。
(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图甲),某研究小组测定两组实验中I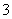 浓度和体系pH,结果见图乙和下表。
浓度和体系pH,结果见图乙和下表。
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是______________。
②图甲中的A为________。由Fe3+生成的A的过程能显著提高I-的转化率,原因是____________________________________________________。
③第2组实验进行18 s后,I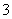 浓度下降。导致下降的直接原因有(双选)________。
浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小
C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图乙,计算3~18 s内第2组实验中生成I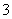 的平均反应速率(写出计算过程,结果保留两位有效数字)。
的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
(1)已知:2SO3(g)2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2 mol SO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
①反应达平衡所需时间:A________B(填“>”、“=”或“<”,下同);达平衡时SO3的转化率:A________B。
②若平衡后,向A、B中分别充入稀有气体,________(填“A”或“B”)容器中的平衡将向________(填“正反应”或“逆反应”)方向移动。
(2)一定条件下,有反应:X(g)+2Y(g)2Z(g) ΔH=Q kJ/mol,该反应的平衡常数表达式为________。
①在体积为2 L的密闭容器C中,充入1 mol X和2 mol Y进行反应,2 min后反应达到平衡,此时平衡混合物中X为0.8 mol,则以Y浓度变化表示的反应速率为________mol/(L·min),X的转化率为________。
②在恒温恒压条件下,向密闭容器D中充入0.5 mol X和1 mol Y,达到平衡后Z的物质的量分数为a,如果再向容器中充入0.5 mol Z,重新平衡后Z的物质的量分数为b,则a________b(填“>”、“<”或“=”)。
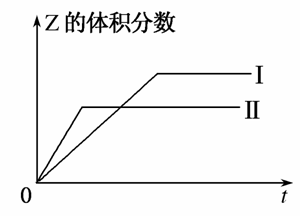
③如图所示曲线Ⅰ、Ⅱ是该反应在只有一个反应条件不同时Z的体积分数与时间的关系图,下列有关曲线Ⅰ、Ⅱ的叙述,正确的是________(填字母)。
A.Ⅰ没有用催化剂,Ⅱ用了催化剂
B.Ⅱ的反应温度比Ⅰ高且Q<0
C.Ⅱ的压强比Ⅰ大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com