
科目: 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = kJ·mol-1。
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K≈ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1,简述该设想能否实现的依据: 。
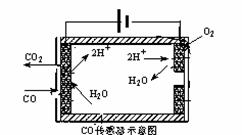
 ②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
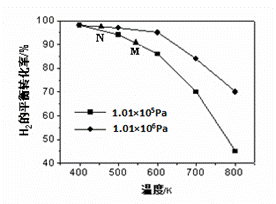
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
①该反应的△H 0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
查看答案和解析>>
科目: 来源: 题型:
已知,在450℃并有催化剂存在下进行如下反应:
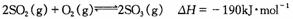
(1)硫酸工业中,该反应需要通入过量空气的目的是 ;该反应不在更高温度下进行的原因是 。
(2)在容积固定的密闭容器中,下列情况已达到平衡状态的是 。
A.v(O2)正=2v(SO3)逆 B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的原子总数不随时间而变化
(3)当向上述平衡体系中通入18O2气体,再次达到平衡时,18O存在于 中。
A. SO2、O2 B.SO2、SO3 C.SO3 D.SO2、SO3、O2
(4)在一个固定容积为2L的密闭容器中充入0.20 mol SO2和0.10mol O2,在450℃并有催化剂条件下,2分钟后达到平衡,测得容器中含SO30.16mol,则
v(O2)= mol( L·min-1);放出的热量为 kJ;该温度下的平衡常数为 ;若继续通入0.20mol SO2和0.10mol O2,则再次平衡时,二氧化硫的转化率 (选填“变大”或“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.NaOH c.Mg(OH)2 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可水解生成Mg(OH)Cl,写出相关的化学方程式 。所以,为了抑制MgCl2·6H2O在加热时水解,可在干燥的
气流中加热,可得到无水氯化镁。
(5)用惰性电极电解熔融的MgCl2,阳极的电极反应式为: ;
如果电解MgCl2溶液,阴极的电极反应式为: 。
查看答案和解析>>
科目: 来源: 题型:
已知:2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是 ( )
CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是 ( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)=1.6 mol·L-1
C. 平衡时,反应混合物的总能量减少40 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
查看答案和解析>>
科目: 来源: 题型:
下列溶液中各微粒的浓度关系错误的是 ( )
A.0.1 mol·L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+)
B.0.1 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO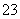 )+c(OH-)
)+c(OH-)
C.25℃时,有等浓度的①NH4HSO4溶液、②NH4HCO3溶液中c(NH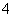 ):①>②
):①>②
D.含等物质的量的NaX和弱酸(HX)混合溶液中一定存在:c(Na+)>c(X-)
查看答案和解析>>
科目: 来源: 题型:
利用下列可逆反应可以将粗镍转化为纯度99.9%的高纯镍:
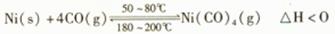
下列说法正确的是 ( )
A.50~ 80℃时,适当增大压强,有利于Ni(CO)4的生成
B.180~ 200℃时,气态的Ni(CO)4会分解出纯Ni
C.提纯过程中,CO(g)的量不断减少
D.温度越高,Ni(CO)4(g)的转化率越低
查看答案和解析>>
科目: 来源: 题型:
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是
A.充电时,阴极的电极反应为: ( )
Ni(OH)2+OH--e-===NiO(OH)+H2O
B.放电时,负极的电极反应为:H2-2e-+2OH-=== 2H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连

查看答案和解析>>
科目: 来源: 题型:
若pH=3的酸溶液和pH=11的碱溶液等体积混合后 溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和二元强碱溶液反应
查看答案和解析>>
科目: 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:
Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达到平衡时:c(Mn2+)/c(Cu2+) =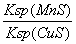
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.MnS(s)的浊液中加入少量可溶性MnSO4固体后, c(S2-)变大
查看答案和解析>>
科目: 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )
A.该反应热ΔH=(a-b)kJ·mol-1
B.AB(g)=== A(g)+B(g) ΔH=b/2kJ·mol-1
C.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com