
科目: 来源: 题型:
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知:
A(s)+B(g)====C(g)+D(g) ΔH=+131.4 kJ·mol-1,
某同 学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
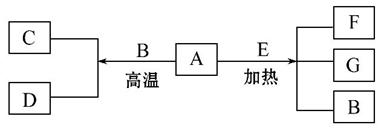
(1) 写出A元素的名称________。
写出A元素的名称________。
(2)另外知:A(s)+O2(g)====G(g) ΔH=-393.6 kJ·mol-1
C(g)+ O2(g)====G(g) ΔH=-283 kJ·mol-1
O2(g)====G(g) ΔH=-283 kJ·mol-1
D(g)+ O2(g)====B(g) ΔH=-242 kJ·mol-1
O2(g)====B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?___________,理由是___[.Com ]
]
____________________________________________________。
(3)写出A+O2→C的热化学方程式:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+ O2(g)==== SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是_________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)====NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)= ===N2(g)+
===N2(g)+ 2C
2C O2(g) ΔH=-bkJ·
O2(g) ΔH=-bkJ· mol-1(b>0)
mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)====4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g )====2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
)====2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2整个过程中放出的热量为867 kJ,则ΔH2=________。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.图甲是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):_____________。
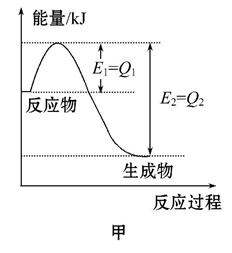
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=____________;
4NH3(g)+3O2(g) ΔH=____________;
(2)饮用水中的N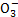 主要来自于N
主要来自于N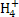 。已知在微生物的作用下,N
。已知在微生物的作用下,N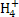 经过两步反应被氧化成N
经过两步反应被氧化成N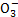 。两步反应的能量变化示意图如图乙:
。两步反应的能量变化示意图如图乙:
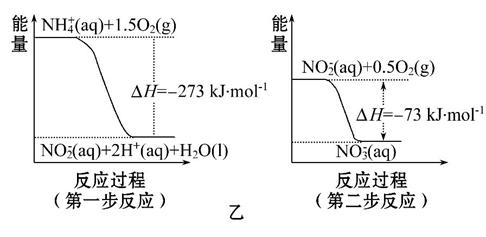
1 mol N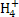 全部被氧化成N
全部被氧化成N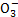 的热化学方程式为___________________________。
的热化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为______;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)====N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)====N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式____________;
(4)肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为___
______________________________。
查看答案和解析>>
科目: 来源: 题型:
已知2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)
2SO3(g) ΔH=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)
1 mol SO2和0.5 mol O2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目: 来源: 题型:
盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步完成,整个过程的热效应是相同的。已知:
①H2O(g)====H2O(l) ΔH1=-Q1kJ·mol-1
②C2H5OH(g)====C2H5OH(l) ΔH2=-Q2kJ·mol-1
③C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH3=- Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)( )
A.Q1+ Q2+ Q3 B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3 D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目: 来源: 题型:
根据碘与氢气反应的热化学方程式:
(ⅰ)I2(g)+H2(g) 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g) 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
查看答案和解析>>
科目: 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl(g)+O2(g)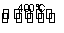 2Cl2(g)+2H2O(g),可实现氯的循环利用。已知4 mol HCl被氧化可放出115.6 kJ的热量。下列说法正确的是( )
2Cl2(g)+2H2O(g),可实现氯的循环利用。已知4 mol HCl被氧化可放出115.6 kJ的热量。下列说法正确的是( )
A.该反应的热化学方程式是4HCl(g)+O2(g) 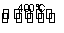 2Cl2(g)+2H2O
2Cl2(g)+2H2O
ΔH=-115.6 kJ·mol-1
B.将36.5 g HCl(g)和8 g O2(g)充入一密闭容器中发生反应,反应放热28.9 kJ
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入4 mol HCl和1 mol O2反应后放出的热量为Q1kJ,若通入8 mol HCl和2 mol O2反应后放出的热量为Q2kJ,则231.2>Q2>2Q1
查看答案和解析>>
科目: 来源: 题型:
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
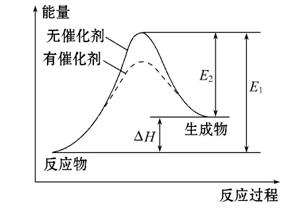
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
科目: 来源: 题型:
1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,则( )
A.1 mol H2和0.5 mol O2断键吸收的能量大于1 mol H2O(g)断键吸收的能量
B.氢气的燃烧热为241.8 kJ·mol-1
C.1 mol H2O(l)的能量大于1 mol H2O(g)的能量
D.2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com