
科目: 来源: 题型:
除去下列物质中所含少量杂质的所选试剂不正确的是( )
| 物 质 | 杂 质 | 试 剂 | |
| A | Cl2 | HCl | 饱和食盐水 |
| B | CO2 | HCl | 饱和Na2CO3溶液 |
| C | 金属镁 | 金属铝 | 稀NaOH溶液 |
| D | FeCl2 | FeCl3 | 铁粉 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 含有大量Fe2+的溶液中:H+、Mg2+、ClO﹣、NO3﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 能使Al溶解产生H2的溶液中:NH4+、Na+、SiO32﹣、HCO3﹣ |
查看答案和解析>>
科目: 来源: 题型:
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质.
|
| A. | ①②③⑤ | B. | ②③⑤ | C. | ②③ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:
化学在工业生产和日常生活中有着重要的应用.下列说法正确的是( )
|
| A. | 陶瓷、水泥和光导纤维均属于硅酸盐材料 |
|
| B. | Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
|
| C. | 常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
|
| D. | NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色 |
查看答案和解析>>
科目: 来源: 题型:
水是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。有关水的反应有很多,依据题意回答下列问题。
(1)水分子自身电离出电子数相等的阴、阳两种离子,其中阳离子的化学式为________。
(2)常温下,某溶液中由 水电离的c(H+)=1×10-12mol·L-1,该溶液可能是________。
水电离的c(H+)=1×10-12mol·L-1,该溶液可能是________。
①二氧化硫水溶液 ②氯化铵水溶液 ③碳酸氢钠水溶液 ④氢氧化钠水溶液
(3)写出有水参与的氧化还原反应,但水既不是氧化剂也不是还原剂,写出离子方程式:______________________ _______________ _______________________
_______________ _______________________ _________(任写一个)。
_________(任写一个)。
(4)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO 和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式:_____________ _______________________________________________________。
和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式:_____________ _______________________________________________________。
(5)CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206kJ·mol-1;又知CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802kJ·mol-1。试写出由CO2与H2O反应生成CO的热化学方程式:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
联 合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是________(填字母序号)。
A.电解水制氢:2H2O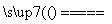 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O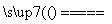 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O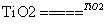 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O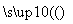 CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7kJ·mol-1
CH3OH(g) ΔH=-90.7kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为_____ ______________________________
______________________________
______________________________________________________________________。
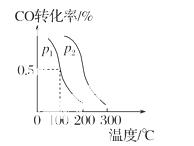
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“ =”),上述反应的ΔH________0(填“<”、“>”或“=”)。
=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
硅及其化合物是重要的非金属材料。由石英砂制取高纯硅的主要化学反应有:
①粗硅的制取:SiO2+2C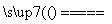 Si(粗)+2CO
Si(粗)+2CO
②粗硅中Si与Cl2反应:Si(s)+2Cl2(g)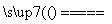 SiCl4(g) ΔH=-akJ/mol
SiCl4(g) ΔH=-akJ/mol
③粗硅的提纯反应:SiCl4(g)+2H2(g)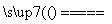 Si(s)+4HCl(g)'ΔH
Si(s)+4HCl(g)'ΔH
请回答下列问题:
(1)上述三个反应都属于________(填反应类型)。
(2)已知1mol Si固体中有2mol Si-Si键,1mol O2中有1mol O=O键,1mol SiO2固体中有4mol Si-O键。某些化学键数据如下:
| 化学键 | Si-O | Cl-Cl | H-H | H-Cl | Si-Si | O=O |
| 断键所需能量/(kJ·mol-1) | 460 | 243 | 436 | 431 | 176 | 498 |
根 据化学键数
据化学键数 据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
(3)可由反应②和另一个反应______________________________ (填化学方程式)通过盖斯定律计算获得反应③的反应热,若该反应每生成1mol化合物的反应热ΔH=-bkJ/mol,则反应③的反应热ΔH=________kJ/mol(用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式分别为:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3kJ·mol-1,
H2O(l)===H2O(g) ΔH=+44kJ·mol-1;
则356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷
气体完全燃烧生成液态水,放出的热量为________。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为_________________________________________________________;
(3)家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧反应的热化学方程式___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
甲醇是一种可再生能源,具 有广泛的开发和应用前景。
有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)  CH
CH 3OH(g)+H2O(g) ΔH2
3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0  kJ·mol-1
kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+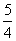 O2(g)===
O2(g)===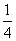 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为__ ______________。
______________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________, 反应过程中放出的热量为________。
反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
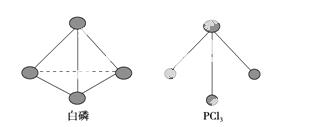
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com