
科目: 来源: 题型:
【化学——选修5 有机化学基础】(15分)
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)
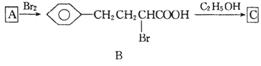
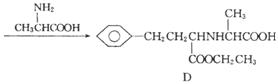
(1)A、C的结构简式分别是
___________________________、 ___________________ ,
D中含有的含氧官能团名称是 。
(2)C→D的反应类型是 。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是
_______________________________ ____________________________________________。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构
简式:
___ ________________________ 。
①能发生银镜反应 ②一定条件下可发生水解反应 ③分子的核磁共振氢谱中有四组峰
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的
化学方程式:
查看答案和解析>>
科目: 来源: 题型:
【化学——选修3物质结构与性质】(15分)
A、B、C、D、E、F为周期表中前四周期的六种元素,它们的原子序数依次增大,且均不同族。A、B、C三种元素的基态原子具有相同的能层和能级,且第一电离能I1(A)<I1(C)<I1(B),BC2+与AC2互为等电子体;D、E为同周期相邻元素;F元素位于周期表中1~18列中的第11列。请回答下列问题(答题时请用相应的元素符号表示相应元素):
⑴A元素的价层电子排布图为 ;BC2+的电子式为 ;
基态F原子的核外电子排布简式 。
⑵E元素的电离能情况如图1所示。E元素在周期表中位于 ; D元素单质形成的晶体晶胞类型属于 堆积。
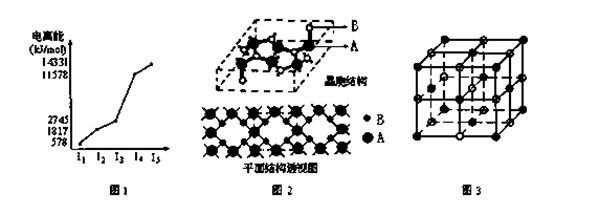
⑶A、B两元素所形成的化合物甲是首屈一指的超硬新材料,其晶胞结构如图2所示,由此可知,化合物甲的晶体类型为 ,其硬度超过金刚石的原因是 。化合物甲的晶体中B原子的杂化方式为 。
⑷D、C两元素可形成的化合物乙。
①现证实化合物乙的晶体结构如图3所示,晶胞中D离子的配位数为 ;
②设D离子半径分别为a,C离子半径分别为b,则其晶体的空间利用率为 。
查看答案和解析>>
科目: 来源: 题型:
煤气化是有效利用化石能源手段之一,有关反应如下:
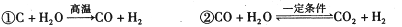 |
获得的气体称为水煤气。某研究性学习小组为探究气体的成分进行了如下实验:
【实验】使水蒸气通过灼热的焦炭,收集反应后流出的气体。
【提出假设】对气体的成份提出了三种假设。
假设1:该气体是CO、H2 假设2:该气体是C0、H2、H20。(
⑴假设3: ______________________________________
【设计实验方案,验证假设】
他们拟用T图中提供的仪器,选择必要的试剂,设计一个实验,验证上述假设(加热装置和导管等在图中略去,实验前P置内部的空气已经排尽)。
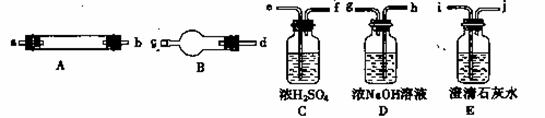
(2 )按气流从左至右连接各仪器,用题中小写字母表示接口连接顺序(仪器可重复使用)混合气
→dc →_______→_______→ij →_______→_______→_______→ij;
(3) 仪器A中需加入试剂的是____________,其中反应的化学方程式是
______________________________________________________________;
(4) 仪器B中需加入试剂的名称是_______________,其作用是_________________________;
(5)本实验的尾气需要处理,处理的方法为:____________________________________,
(6) 某同学认为增加焦炭的量可以提高化学反应①的速率,你是否同意他的说法,并简述理由___________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制备Al2O3、K2FeO4和H2SO4的工艺流程如下: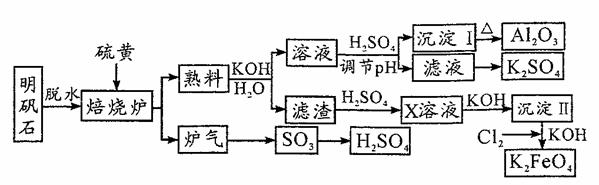
请回答下列问题:
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S =2Al2O3 +9SO2,该反应中氧化剂与还原剂的物质的量之比是 _ 。若生成102g Al2O3,转移的电子数目为 。
(2)写出化学式:沉淀Ⅰ是 ,沉淀Ⅱ是 ___________ 。
(3)熟料溶解时反应的离子方程式为______________________________________________。
(4)溶液经加硫酸调节pH后,过滤、洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 。
(5)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式:
______________________________________ 。
(6)“焙烧”过程中生成的SO2可用于制H2SO4。已知25℃,101kPa时:
2SO2(g) + O2(g)  2SO3 (g) △H1=-197.0kJ•mol-1
2SO3 (g) △H1=-197.0kJ•mol-1
H2O(g)=H2O(l) △H 2=-44.0 kJ·mol-1
2SO2(g) + O2(g) + 2H2O(g) =2H2SO4 (l) △H3=-545kJ•mol-1
则SO3 (g)和H2O(l)反应的热化学方程式为 _________ 。
(7)本工艺流程中可循环物质为__________________________。
查看答案和解析>>
科目: 来源: 题型:
2013年9月以来,我国很多地区大面积出现雾霾,特别是华中华北尤其严重,汽车尾气、燃煤废气和冬季取暖排放的CO2等都是形成雾霾的原因。
 (1)用于净化汽车尾气的反应为: 2NO(g)+2CO(g)
(1)用于净化汽车尾气的反应为: 2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
2CO2(g)+N2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是___________
A.在单位时间内生成1molCO2的同时消耗了1molCO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。镍与CO反应的化学方程式为Ni(s)+4CO(g)
 Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
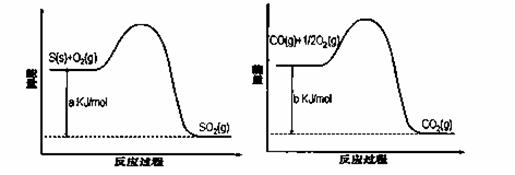
则用SO2除去CO的热化学方程式为__________________________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________________________。
2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________________________。
(4)已知反应:CO(g) + H2O(g)
 CO2(g) + H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g) + H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=____________________(保留小数点后二位)
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______________
③该反应的△H__________O(填“>”或“<”);若在900℃时,另做一组实验,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时V正 __________V逆(填“>”或“<”)
查看答案和解析>>
科目: 来源: 题型:
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
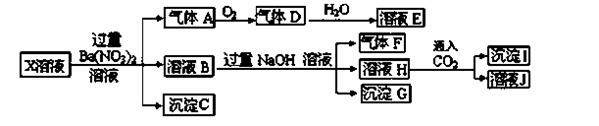 下列说法正确的是
下列说法正确的是
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 A13+和C1―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com